Publié le 14 mai 2015Lecture 13 min
Quoi de neuf dans les prothèses valvulaires ?
T. FOLLIGUET, CHU Brabois, Université de Lorraine, Vandœuvre-lès-Nancy
Les prothèses valvulaires pouvaient jusqu’en 2002 être classées en deux grands groupes ; les prothèses biologiques et les valves mécaniques. Depuis 2002, date à laquelle la première valve percutanée a été implantée chez l’homme, de nombreuses valves biologiques ont été développées, notamment les valves à déploiement rapide ou sans sutures. Nous allons revoir les indications et les avantages et inconvénients de ces prothèses.
Valves mécaniques
Les valves mécaniques sont divisées en trois groupes essentiels.
• Prothèses à bille type la valve de starr-Edwards®, qui bénéficie du plus important recul. La bille se déplaçant entre le sommet de la cage et l’anneau d’insertion.
• Prothèses à disque basculant comme les valves de Bjork-Shiley®, Lillehei-Kaster®, Allcarbonv, Omniscience®, Medtronic- Hall®, Omnicarbon®, etc. qui comportent un seul disque.
• Prothèses à deux disques ou à ailettes comme la Saint-Jude Médical®, Carbomédics®, Sorin- Bicarbon®, etc. qui offrent actuellement le meilleur profil hémodynamique des prothèses mécaniques.
Ces prothèses sont exceptionnellement sujettes à une détérioration intrinsèque, mais les principales complications sont les thromboses, la fuite périprothétique, et les complications infectieuses liées à une endocardite.
Toutes ces prothèses ont une collerette placée à l’extérieur de la prothèse de manière à permettre leur implantation chirurgicale en position intraannulaire ou supra-annulaire (au-dessus de l’anneau aortique) pour les prothèses aortiques. Dans tous les cas, la technique d’insertion se fait grâce à une seule ligne de suture. Cependant en plaçant la prothèse au-dessus de l’anneau aortique soit en position supra-annulaire par rapport à une insertion intraannulaire on peut ainsi « gagner » une taille et donc mettre une prothèse d’une taille supérieure.
Les gradients moyens, au repos varient entre 9 et 22 mmHg et les surfaces de 0,9 à 2,2 cm2 suivant le type de prothèse aortique, avec des gradients plus faible pour les valves à doubles ailettes.
Plusieurs études prospectives randomisées comparant l’auto - contrôle hebdomadaire de l’INR par le médecin traitant et par le patient pour un INR cible entre 2 et 3 montrent une très bonne efficacité avec un faible taux d’accidents thromboemboliques et hémorragiques. L’étude PROACT est une étude randomisée comparative comportant sur une faible cohorte (375 patients ayant un RVA avec une valve aortique bileaflet On-X), comparant 2 groupes d’INR ciblé (entre 2 et 3, et entre 1,5 et 2) avec autocontrôle de l’INR. Tous les patients recevaient 81 mg d’aspirine en plus du traitement anticoagulant. Le groupe à faible INR présentait un taux de complications hémorragiques inférieures au groupe INR entre 2 et 3 sans plus de complications thrombotiques.
La recherche actuelle est axée sur le revêtement des ailettes en recherchant des matériaux permettant d’éviter une anticoagulation à long terme.
Bioprothèses
De nombreux substituts valvulaires ont été proposés, mais le choix actuel des bioprothèses classiques est porcines ou bovines et utilisent la valve native de l’animal ou le péricarde. Actuellement le substitut péricardique semble donner une meilleure longévité avec une dégénérescence moindre et une meilleure hémodynamique en faveur des valves péricardiques bovines.
Bioprothèses avec armature
Ces substituts sont montés sur des stents ou armatures rigides qui permettent de maintenir la valve en position en reproduisant le contour des commissures aortiques.
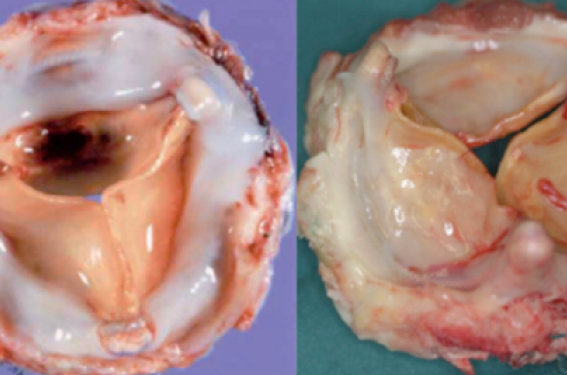
Ces valves sont donc insérées suivant la même technique chirurgicale que les valves mécaniques soient par une seule ligne de suture placée au niveau de l’anneau aortique. Ces valves évoluent inévitablement vers la dégénérescence de manière progressive due à un phénomène de calcification responsable à long terme d’une obstruction et/ou d’une fuite prothétique (figure 1).
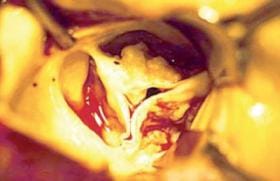
Figure 1. Valve Perimount dégénérescence, calcifications et pannus.
Parfois peut se produire la déchirure d’un feuillet qui survient le plus souvent au niveau d’un point d’insertion sur l’armature (figure 2).
Figure 2. Perforation d’une sigmoïde liée à une endocardite.
Plus rarement, une dysfonction intervient liée à une endocardite, une thrombose, ou une fuite périprothétique. Les gradients moyens au repos pour ces valves varient entre 10 et 23 mmHg et les surfaces de 1,1 à 2,8 cm2 suivant le type de valve.
Bioprothèses sans stent dites « stentless »
La particularité de ces valves est qu’elles ne sont pas montées sur un support fixe.
À taille égale, elles offrent une surface prothétique effective plus grande que les valves à armature. Un autre avantage théorique est une meilleure hémodynamique avec moins de friction au niveau des cusps et donc moins de risques de déchirures. Cependant les inconvénients sont liés à la difficulté d’implantation de ces valves. Suivant les modèles deux techniques chirurgicales existent :
La technique du « freehand » ou technique infracoronaire est calquée sur la technique des homogreffes aortiques avec une ligne de suture au niveau du culot aortique seule (figure 3), ou également une deuxième ligne de suture au niveau des commissures sur l’aorte ascendante.
Le problème lié à cette technique est essentiellement l’orientation des commissures aortiques ainsi que le choix de la taille de la prothèse. En effet, les distorsions des commissures aortiques ainsi qu’une sous- ou surélévation de la taille de la prothèse peuvent entraîner une insuffisance aortique centrale par défaut de coaptation des feuillets. Enfin cette technique est contre-indiquée en cas de calcifications importantes de l’aorte ascendante.
Figure 3. Valve Solo nécessitant une seule ligne de suture. Bioprothèse de péricarde bovin.
La technique du « miniroot » s’apparente à la technique du Bentall avec insertion de la bioprothèse au niveau de l’anneau aortique par des points séparés. Les ostia coronaires sont réimplantés sur la bioprothèse au niveau des orifices préalablement effectués. La partie supérieure de la valve est cousue au pourtour de l’orifice supérieur aortique. Des hématomes entre la paroi aortique et la paroi de la bioprothèse peuvent survenir et être à l’origine d’une compression significative.
Dans ces deux techniques, le temps d’insertion est plus long que pour des prothèses mécaniques ou biologiques avec armature.
De nombreuses études retrouvent avec ces valves des gradients transprothétiques faibles et des surfaces prothétiques valvulaires larges. Cela se traduit par une diminution plus rapide de l’hypertrophie ventriculaire gauche à moyen terme. Cependant trois études randomisées comparant remplacement valvulaire aortique avec des bioprothèses avec ou sans armatures n’ont pas montré d’avantage en termes de régression de l’hypertrophie ventriculaire ou de gradient transprothétique, et également pas d’avantage sur le clinique à moyen terme. Une autre étude comparant les bioprothèses avec ou sans armature ne retrouvent pas de différences au repos et à l’effort entre le gradient moyen et la surface prothétique.
À la vue de ces différentes études, il est donc difficile à l’heure actuelle de proposer ces valves sans armature de manière préférentielle liée à la difficulté accrue d’insertion et du risque plus grand de malcoaptation des feuillets aortiques.
Les valves à déploiement rapide ou dites « sutureless » (sans suture) ont été développées afin de pouvoir être insérées dans l’anneau aortique plus rapidement et plus facilement que les bioprothèses standards. L’intérêt est de diminuer le temps de clampage et de circulation extracorporelle en éliminant la mise en place de fils de fixation intraannulaire car ces prothèses tiennent au niveau aortique grâce à leur force radiaire. Ceci permet de réduire d’environ 30 à 50 % le temps de clampage. Par ailleurs, ces prothèses sont inspirées des valves percutanées, en associant un stent en acier ou en nitinol sur lequel est cousu directement le péricarde, ce qui permet d’obtenir un orifice valvulaire fonctionnel plus grand pour un même orifice annulaire. En éliminant le support et la collerette de Dacron, le diamètre interne de la prothèse correspond au diamètre de l’anneau aortique. Ces prothèses ont donc des gradients transvalvulaires faibles, ce qui est un avantage pour les petits anneaux. Grâce à leur fixation sans suture, elles sont facilement implantées dans des culots aortiques calcifiés par exemple lors de réopération d’homogreffe aortique.
Enfin, en cas de chirurgie concomitante par pontage, la valve est préparée lors de la confection des pontages, puis insérée rapidement, ce qui permet de réduire le temps de clampage aortique.
Par ailleurs, on observe un très faible taux d’endocardite de l’ordre de 0,5 % par an, peutêtre du fait de l’absence de collerette de Dacron et/ou d’une meilleure hémodynamique.
Trois modèles sont disponibles sur le marché
La valve Perceval de Sorin (figure 4) est la seule valve qui tient sans suture. C’est une bioprothèse bovine montée sur un stent en nitinol renforcé par une collerette de péricarde. Elle se positionne en position intraannulaire. Son maillage large empêche toute obstruction coronaire et son large stent déployé dans les sinus de Valsalva permet de fixer la prothèse sans risque de migration. Plusieurs études prospectives ont prouvé sa facilité d’insertion et ses faibles gradients. Un recul de 6 ans actuellement sur les 30 premiers patients montre un faible taux de dégénérescence comparable aux autres bioprothèses péricardiques. Sa première implantation remonte à avril 2007.
Figure 4. Valve Perceval (Saluggia, Italie).
Le modèle Enable 3f (figure 5) est une bioprothèse qui est placée en position intra-annulaire, avec trois sections égales de tissu péricardique équin, un cadre autoextensible en ninitol couvert d’un tissu en polyester sur la partie proximale, une collerette en polyester et trois languettes commissurales équidistantes. La première implantation date de janvier 2005.
Elle est fixée par un ou deux points transannulaires.
Figure 5. Valve 3f Enable de Medtronic (Minneapolis, États- Unis).
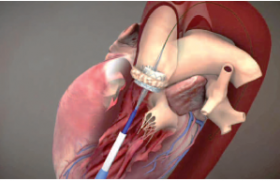
La valve Intuity d’Edwards (figure 6) est composée de trois feuillets de péricarde bovin d’épaisseur et d’élasticité identiques avec armature en alliage, stent en acier inoxydable et tissu en PTFE. La valve est positionnée en supra-annulaire alors que la partie proximale est dans la chambre de chasse du ventricule gauche après avoir été déployée à l’aide d’un ballon introduit au travers de la valve. La valve est fixée à l’anneau aortique par trois points transannulaires. La première implantation remonte à janvier 2010.
Figure 6. Valve péricardique bovine Intuity, Edwards Lifesciences (Irvine, États-Unis).
La technique chirurgicale peut varier en fonction du choix de ces valves car une circulation extracorporelle est toujours obligatoire ainsi qu’une ablation des sigmoïdes aortiques. Par contre, ces prothèses peuvent être mises au travers d’une miniincision telle qu’une ministernotomie ou une minithoracotomie, car elles ne requièrent que très peu de fils de suture, ce qui permet de diminuer le temps de clampage aortique.
Ces valves ont été validées grâce à plusieurs études prospectives incluant plus de 700 patients. Outre les avantages décrits cidessus, on observe un taux de fuite paravalvulaire plus important que pour les prothèses standards de l’ordre de 5 %, ceci est lié au fait que l’anneau aortique n’étant pas circulaire mais ovale, il y a de ce fait une part possible de mauvaise congruence entre l’anneau aortique et la prothèse valvulaire qui est circulaire. De ce fait, leur usage n’est pas recommandé dans les bicuspidies car l’anneau est alors très ovalaire.
Un taux de bloc atrio-ventriculaire entraînant la mise en place de pacemaker est également plus important de l’ordre de 7 % avec ces prothèses du fait de la présence d’une « jupe » dans la chambre de chasse du ventricule gauche, et de la nécessité de « ballonner » la prothèse comme pour les valves percutanées de manière à optimiser sa fixation annulaire.
Enfin la durabilité de ces valves reste à être étudiée à long terme car actuellement le recul maximal est de 6 ans.
De ce fait, actuellement ces valves sont indiquées pour des patients âgés et/ou avec des comorbidités élevées pour lesquelles une réduction du taux de clampage est souhaitable, mais également en cas de chirurgie concomitante.
On observe une augmentation régulière de la mise en place des valves sans sutures en position aortique dans les dernières années (figure 7). Seules des études randomisées pourront permettre de valider ces bioprothèses par rapport aux bioprothèses standards.
Figure 7. Évolution des valves sans sutures dans le monde.
Valves percutanées
Depuis la première implantation en 2002 par Alain Cribier, ces prothèses ont démontré leur efficacité chez des patients à haut risque opératoire ou porteurs de facteurs de risque particuliers comme une insuffisance respiratoire ou une insuffisance hépatique.
L’absence de circulation extracorporelle et/ou d’anesthésie générale permet une récupération rapide avec un retour rapide à domicile.
L’étude Partner B randomisée a montré la supériorité de la technique par rapport au traitement médical avec une différence de survie de 24,7 % à 2 ans en faveur du TAVI, et l’étude PARTNER A la non-infériorité de la technique par rapport au traitement chirurgical classique pour les patients à haut risque.
Ces résultats ont également été confirmés par l’étude PIVOTAL (figure 8) randomisant des patients à haut risque soit à la chirurgie standard, soit à la mise en place d’une valve à déploiement rapide, qui montre une meilleure survie à 12 mois pour le groupe valve autoexpansible. On note également une amélioration des symptômes à moyen terme, avec une meilleure qualité de vie.
Figure 8. Étude PIVOTAL. NEJM mars 2014.
Cependant il s‘agit de patients « à haut risque » et fragiles car la mortalité à 2 ans est de 35 % dans PARTNER A et de 43 % dans PARTNER B. La moitié des décès à moyen terme est due à des causes extracardiaques soulignant le rôle des comorbidités. Dans le registre Source rapporté en 2011 sur 1 038 patients, on retrouve 179 décès survenus entre 30 jours et 1 an et 49 % sont de causes extracardiaques. Ces chiffres sont à peu près similaires dans le registre France 2 en 2012 (Gilard M for France 2 investigators. N Engl J Med 2012 ; 366 : 1 705-15).
Par ailleurs cette technique ne doit pas être utilisée pour les patients à très haut risque (EuroScore > 40) car la mortalité à moyen terme reste très élevée de 5,7 % à 30 jours et une survie de 55 % à 2 ans.
Les complications propres inhérentes à la technique sont : les complications neurologiques, les complications vasculaires, les troubles conductifs à type de BAV et les fuites paraprothétiques.
Les fuites paravalvulaires sont présentes dans près de 40 % des cas. Cependant la nouvelle valve Sapien 3 qui incorpore une jupette en péricarde permet de réduire significativement ces fuites qui sont de l’ordre de 3 à 5 % suivant les études.
La voie fémorale reste utilisée de manière préférentielle dans 80 % des cas. En cas d’impossibilité d’utilisation liée au diamètre trop petit des axes fémoraux iliaques (< 7 mm), de calcifications ou de tortuosités des voies alternatives sont possibles : transapicale, carotidienne, directe aortique.
La voie transapicale permet un accès direct au ventricule et l’insertion de la prothèse se fait dans l’axe de l’aorte, ce qui facilite le déploiement. Son inconvénient est lié à la thoracotomie et à ses complications propres.
La voie carotidienne peut être utilisée lorsque les axes carotidiens sont > 7 mm sans calcifications et si le cercle de Willis est perméable. Elle offre un accès relativement direct à l’anneau aortique et peut se faire sous anesthésie locale ou générale.
La voie directe aortique est en général réalisée au travers d’une minithoracotomie droite ou d’une ministernotomie. L’étude du scanner préopératoire permet de choisir la meilleure voie en fonction de l’anatomie de l’aorte ascendante. Son avantage par rapport à la voie transapicale est l’absence de points sur le ventricule gauche qui peuvent être fragiles chez les patients âgés et en cas de dysfonction ventriculaire gauche sévère.
En France ces prothèses peuvent être mises après concertation multidisciplinaire associant un chirurgien cardiaque, un cardiologue interventionnel, un cardiologue clinicien et/ou un gériatre. Il est recommandé pour les patients dits à haut risque soit ayant un Euro - Score > 20 et un score STS > 10. Cependant en cas de score de risque moindre, l’association de facteurs de risque spécifiques comme une insuffisance respiratoire sévère, une insuffisance hépatique ou dans le cas de chirurgie redux cette technique peut être proposée.
Par ailleurs plusieurs études sont en cours concernant les patients à risque intermédiaire par rapport au remplacement valvulaire standard.
Actuellement seules deux prothèses sont remboursées en France ; Medtronic Corevalve qui est une valve autoexpansible en nitinol avec du péricarde porcin, et Edwards Sapien, valve à déploiement par ballonnet en acier avec du péricarde bovin, mais de nombreuses autres prothèses sont en cours d’évaluation avec des valves recapturables permettant une mise en place optimale. La taille des introducteurs est également réduite à 14 French, ce qui augmente l’utilisation de la voie fémorale.
L’utilisation du scanner et de l’échographie 3D permet d’effectuer un calcul très précis de l’anneau aortique, de la chambre de chasse et de l’aorte ascendante, mais également des axes iliofémoraux et des troncs supraaortiques. Ceci permet de choisir la meilleure valve en fonction de l’anatomie du patient (calcifications aortiques, bicuspidie), la meilleure voie d’abord, et également la taille de la prothèse.
Dans le cas de prothèses aortiques en place dégénérées, la possibilité de valve-in-valve est maintenant bien maîtrisée. Le choix de la prothèse à mettre dépend de la prothèse en place, mais en général on choisira plutôt une valve à déploiement autoexpansible car elle permet d’épouser plus facilement la forme de la bioprothèse en place, et peut être insérée en position supra-annulaire ce qui offre un meilleur gradient transprothétique.
Certaines contre-indications sont évidentes : anneau aortique trop petit (< 18 mm) ou trop large (> 29 mm), thrombus intraventriculaire, endocardite active, risque d’obstruction coronaire lié à des sinus de valsalva étroits ou à une hauteur de coronaire < 8 mm, plaques mobiles avec des thrombi dans l’aorte thoracique. D’autres sont des contre-indications relatives : dysfonction ventriculaire gauche sévère, les patients à très haut risque (EuroScore > 40), les troubles cognitifs majeurs, ou une espérance de vie < 1 an.
L’estimation de l’espérance de vie est difficile et demande une appréciation multidisciplinaire. Les scores de risques chirurgicaux doivent être associés à une présélection des patients comportant une estimation des troubles cognitifs grâce au MMS, du statut nutritionnel en appréciant la BMI et l’albuminémie, du risque de chute et du risque de dépression par des échelles simplifiées (Geriatric Depression Scale).
SURTAVI STS score entre 3 et 8 survie à 1 an
Enfin, une première étude pour des patients à risque intermédiaire montre une survie à 1 an pour le groupe TAVI traité à l’aide d’une valve autoexpansible et le groupe chirurgical.
De ce fait, il est clair que grâce au progrès et à l’amélioration des techniques et des prothèses, un élargissement des indications vers des patients à risque intermédiaire est inéluctable dans les prochaines années.
On observe une progression de 20 % par an avec les recommandations actuelles dans l’évolution des valves percutanées en France.
Concernant la mortalité à 30 jours des valves implantées par voie fémorale dans les grandes études, on note une diminution notable de la mortalité de par l’amélioration des techniques mais aussi par une meilleure sélection des patients (figure 9).
Dans l’étude PARTNER, on observe une diminution importante des facteurs de risque au fil des études et des registres. Concernant la durabilité à moyen terme de ces prothèses, on observe un taux de dégénérescence identique aux valves chirurgicales à 3 ans.
Figure 9. Mortalité à 30 jours des valves implantées par voie fémorale dans les grandes études.
D’après Webb J et al. J Am Coll Cardiol 2014 ; 64 : 2 235-43
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité