Cardiologie générale
Publié le 31 mai 2016Lecture 11 min
Les maladies du péricarde : diagnostic et prise en charge - Recommandations de la Société européenne de cardiologie
P. GUÉRET, Service de cardiologie, CHU Henri Mondor, Créteil

Depuis les recommandations précédentes de la Société européenne de cardiologie sur les maladies du péricarde rédigées en 2004, de nouvelles données ont été publiées, concernant en particulier l’identification des patients à haut risque de complications, l’apport des différentes modalités d’imagerie cardiaque, les résultats des premières études épidémiologiques ainsi que ceux des essais prospectifs et randomisés sur l’intérêt de la colchicine dans le traitement médical des péricardites. La prise en charge de certaines populations (sujets jeunes, femmes enceintes, etc.) est également mieux précisée.
Pour toutes ces raisons, il a semblé opportun au Comité des recommandations de la Société européenne de cardiologie d’actualiser le document de 2004. Le groupe de travail co-présidé par les professeurs Philippe Charron (Paris) et Yehuda Adler (Ramat-Gan, Israël) a produit un texte très complet de plus de 20 pages, accompagné de 39 tableaux et de 3 figures et de plus de 200 références bibliographiques, et publié dans l’European Heart Journal en novembre dernier.
Voici une sélection des éléments qui apparaissent comme les plus utiles au cardiologue clinicien pour la prise en charge de ces affections.
Fréquence
Les maladies du péricarde peuvent revêtir des formes évolutives variées et reconnaissent de nombreuses étiologies. Elles sont fréquentes, en particulier la péricardite aiguë. À titre d’exemple, son incidence annuelle a été évaluée à 30 cas/100 000 en Europe. Même si la majorité des patients est prise en charge en ambulatoire, les péricardites aiguës représentent 0,1 % des motifs d’hospitalisation et 5 % dans les services d’urgence. Les récidives sont également fréquentes (30 % à 18 mois).
Péricardite aiguë
Un premier aspect largement développé dans ces recommandations concerne la prise en charge de la péricardite aiguë. On retiendra l’individualisation nosologique d’une forme prolongée (ou « incessante ») dont les signes persistent plus de 4 à 6 semaines, différente de la récidive qui sous-entend une phase de rémission temporaire d’au moins 4 à 6 semaines. Cette distinction a des conséquences pour le traitement (tableaux 1, 2 et 3).
Un autre aspect très important est l’identification des patients à haut risque de complications (tamponnade, récidive, évolution vers la constriction) selon des critères cliniques, échocardiographiques et de réponse au traitement médicamenteux. Parmi les facteurs considérés comme majeurs et validés dans des analyses multivariées, on retient la fièvre > 38 °C, l’évolution subaiguë, un épanchement abondant a fortiorimal toléré et une efficacité insuffisante de l’aspirine ou des anti-inflammatoires non stéroïdiens (AINS). Dans ces cas, la prise en charge nécessite une hospitalisation alors que les patients à faible risque peuvent être traités en ambulatoire.
Dans la suite des nombreux travaux de Imazio (Turin, Italie) qui ont démontré son action thérapeutique ainsi que son efficacité pour prévenir les récidives (réduction du risque de 50 %), la colchicine fait maintenant partie intégrante du traitement de la péricardite aiguë, toujours en association à l’aspirine et aux AINS (tableaux 2 et 3). Les doses préconisées sont faibles, adaptées au poids du patient, et fixes contrairement à celles de l’aspirine et des AINS qui nécessitent une lente décroissance posologique. À noter que la colchicine n’a pas actuellement d’indication en cas de myopéricardite (après confirmation de l’atteinte myocardique par l’élévation des troponines et surtout les données de l’IRM).
Les corticoïdes utilisés à des doses faibles et très lentement dégressives, restent un traitement de seconde intention car, initialement très efficaces, ils favorisent la récidive. Ils doivent être associés à la colchicine. En cas d’échec, il est possible d’avoir recours à d’autres médicaments tels que les immunoglobulines, l’azathioprine ou l’anakinra (IIb-C), bien que les preuves convaincantes de leur efficacité manquent encore.
Dans tous les cas, la limitation des activités physiques est de règle, prolongée au moins 3 mois chez les sportifs (IIa-C).
*Commencer à faibles doses afin d’éviter céphalées et sensations vertigineuses.
Épanchement péricardique
Bien qu’il existe des péricardites « sèches », la présence d’un épanchement péricardique est un critère diagnostique et pronostique de la péricardite aiguë. À l’inverse, certains épanchements péricardiques sont totalement asymptomatiques et découverts de façon fortuite sur une radiographie thoracique ou, plus souvent actuellement, en échocardiographie. Ils sont souvent idiopathiques (50 %), plus rarement associés à un cancer (10-25 %), une cause infectieuse (15-30 %), ou bien iatrogène (15-20 %) ou encore dans le cadre d’une connectivite (5-15 %). Dans les pays en voie de développement, la cause principale est la tuberculose. Une fois constitués, ils peuvent occasionner des symptômes, en particulier une dyspnée et dans les formes abondantes entraîner des signes de compression. En l’absence de causes identifiées qui nécessiteraient un traitement spécifique ou de signes inflammatoires qui justifieraient un traitement identique à celui de la péricardite aiguë, la ponction péricardique est souvent indiquée dans les formes mal tolérées ou persistantes sous traitement médicamenteux.
Formes cliniques de péricardites constrictives
L’aspect le plus intéressant du chapitre sur les péricardites constrictives est la présentation de formes cliniques décrites en 2010 et qui méritent d’être mieux connues en raison de leurs conséquences thérapeutiques.
• La constriction péricardique transitoire correspond à une péricardite aiguë avec épanchement modéré, existence de signes d’inflammation en particulier en IRM/scanner cardiaque, et s’accompagnant de signes de constriction mais qui régressent sous traitement anti-inflammatoire. Il est donc important de connaître cette forme clinique afin de n’envisager la péricardectomie qu’après un traitement médical bien conduit pendant 2 à 3 mois.
• Alors qu’il est habituellement absent dans la péricardite constrictive classique, la présence d’un épanchement majore la mauvaise tolérance hémodynamique. Cette association, rare, d’épanchement sur une constriction (« effusive constrictive pericarditis ») correspond le plus souvent à des formes idiopathiques dans les pays développés et à la tuberculose dans les autres pays. Le diagnostic est évoqué lorsque des signes de constriction sont constatés au décours d’une ponction péricardique effectuée chez un patient en état de tamponnade. C’est une des raisons invoquées pour procéder à un monitoring hémodynamique au cours d’une péricardiocentèse qui met en évidence une élévation persistante de la pression auriculaire droite. Par défaut, l’imagerie cardiaque non invasive (échocardiographie Doppler et IRM) peut être contributive. Le traitement consistant à effectuer une ablation chirurgicale précise du feuillet viscéral du péricarde, cette intervention doit être effectuée par des équipes très entraînées.
Imagerie cardiaque
Bien que la radiographie thoracique soit actuellement moins pertinente que les autres méthodes d’imagerie, le groupe de travail a souhaité en conserver la mention dans le texte au motif principal que ces recommandations s’appliquent à tous les pays, y compris les moins bien dotés en termes d’équipement et que dans certaines situations, les renseignements obtenus en particulier sur le parenchyme pulmonaire peuvent être d’une grande utilité diagnostique.
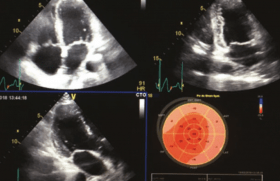
L’échocardiographie reste l’examen de première intention dans pratiquement toutes les situations, non seulement pour la visualisation de l’épanchement mais aussi et surtout pour l’appréciation de sa tolérance hémodynamique et pour le diagnostic différentiel avec la myocardiopathie restrictive, grâce aux données fournies par le Doppler.
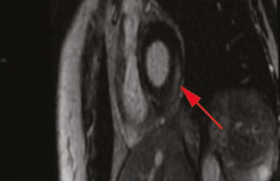
L’imagerie cardiaque en coupes, scanner et IRM, est recommandée en seconde intention. L’avantage du scanner est de pouvoir visualiser les calcifications péricardiques même si elles sont surtout retrouvées dans les formes devenues rares de nos jours de péricardites constrictives évoluant depuis longtemps. L’épaisseur des feuillets péricardiques peut être mesurée par l’une ou l’autre technique mais l’IRM est mieux à même de fournir des renseignements d’ordre fonctionnel sur les ventricules (en particulier l’interdépendance VD/VG) et sur le remplissage ainsi que sur le myocarde en particulier en cas de myopéricardite. Enfin, l’imagerie en coupes fournit des renseignements sur le parenchyme pulmonaire et sur le médiastin, très utiles dans le bilan étiologique.
Formes étiologiques particulières
Les péricardites virales restent les plus fréquentes dans les pays développés. Il est rappelé qu’en raison du grand nombre d’agents pathogènes potentiellement incriminables, de l’absence d’efficacité démontrée de traitements étiologiques spécifiques (à l’exception des virus HIV et HCV) et en raison de leur évolution le plus souvent bénigne sous traitement antiinflammatoire, il n’est pas nécessaire ni utile de procéder à une enquête virologique systématique (recommandations III-C).
L’étiologie tuberculeuse reste actuellement très fréquente dans les pays en voie de développement, et elle peut survenir comme complication chez les patients atteints du sida. Le pronostic est sombre avec un taux de mortalité qui peut atteindre 40 % au terme du 6emois d’évolution, surtout si la prise en charge a été retardée. L’échocardiographie Doppler reste en première ligne pour le diagnostic de l’épanchement et l’appréciation de sa tolérance mais seules les autres méthodes d’imagerie (radiographie thoracique, scanner et IRM) pourront apporter des arguments étiologiques à partir de l’étude du parenchyme pulmonaire et du médiastin. L’épanchement péricardique, souvent abondant, peut être mal toléré et nécessiter une péricardiocentèse sous échographie ou une évacuation chirurgicale, dans ce cas associée à une biopsie péricardique pour confirmer le diagnostic. L’institution d’un traitement antituberculeux spécifique empirique n’est recommandée que dans les zones endémiques en cas d’épanchement exsudatif et après exclusion des autres étiologies.
Le développement d’un épanchement péricardique peut survenir chez les insuffisants rénaux chroniques, en particulier chez les patients hémodialysés. L’intensification du programme d’hémodialyse est recommandée (IIa) mais, point important, la colchicine est contre-indiquée dans cette étiologie.
Les péricardites constituées après infarctus du myocarde aigu, après chirurgie cardiaque ou de cause traumatique (iatrogène ou non) sont regroupées dans un chapitre propre car elles partagent l’existence d’une composante inflammatoire importante et une hypothétique origine auto-immune. Il s’agit souvent de pleuro-péricardites. L’expérience accumulée au cours des 2-3 dernières décennies par l’échocardiographie effectuée après infarctus du myocarde a permis de mieux différencier les formes précoces très fréquentes, souvent peu abondantes, en rapport avec l’étendue de la nécrose mais sans signification pronostique propre et les formes plus tardives, en particulier le syndrome de Dressler devenu très rare (< 1 %) depuis la prise en charge par revascularisation précoce.
Lors de la chirurgie cardiaque, l’ouverture du péricarde est souvent suivie d’un épanchement péricardique disparaissant spontanément en 7-10 jours. Les formes plus abondantes sont souvent mal tolérées. La constitution d’un hémopéricarde peut nécessiter, en cas de compression, une reprise chirurgicale en urgence.
Mais dans l’ensemble, le pronostic de ces formes est habituellement favorable sous traitement anti-inflammatoire, avec un faible taux d’évolution prolongée et de rares formes constrictives. À noter que la colchicine n’a pas montré d’efficacité sur les épanchements péricardiques après chirurgie cardiaque.
La péricardiocentèse suivie d’un drainage prolongé est recommandée dans les épanchements péricardiques néoplasiques mal tolérés. Elle doit être associée à l’analyse cytologique du liquide (I-B) voire à une biopsie (IIa-B) et à une recherche des marqueurs tumoraux (IIa-B). L’instillation intrapéricardique d’agents sclérosants et cytotoxiques adaptés à la tumeur causale est recommandée dans le but de prévenir les récidives (IIa-B).
Enfants et femmes enceintes
Chez l’enfant, les péricardites sont très inflammatoires. L’aspirine doit être évitée en raison du risque de syndrome de Reyes et de toxicité hépatique (III-C). De même, les corticoïdes seront réservés à certaines affections auto-immunes. La colchicine doit être prescrite, à des doses adaptées à l’âge, en cas de récidive. Le traitement de la péricardite aiguë de l’enfant repose donc essentiellement sur les AINS à forte dose (I-C).
Chez la femme enceinte, le développement d’un épanchement péricardique est très fréquent (40 %). Apparaissant dans le courant du 3e trimestre de gestation, il est habituellement modéré et bien toléré, découvert fortuitement, souvent en échocardiographie, et il ne nécessite pas de traitement. En cas de péricardite aiguë, la démarche diagnostique est sans particularité mais le traitement préconisé varie en fonction du stade de la grossesse : les antiinflammatoires (aspirine, AINS) ne peuvent être prescrits que jusqu’à la 20e semaine car audelà, il y a un risque de fermeture du canal artériel et d’insuffisance rénale chez le fœtus.
Perspectives et questions sans réponse
En dépit des nombreuses données récentes et des premières études cliniques d’envergure, il reste des points à éclaircir. Parmi les plus importants, citons l’identification des facteurs responsables de récidive en cas de péricardite aiguë, la durée optimale du traitement qui reste pour l’instant grandement empirique, la justification réelle du repos en cas de péricardite aiguë a fortiori récidivante, l’évolution à long terme des myopéricardites, la physiopathologie des épanchements péricardiques isolés idiopathiques, l’intérêt et les indications des traitements intrapéricardiques, en particulier la fibrinolyse dans les formes infectieuses (tuberculose et épanchements purulents) afin d’éviter la constriction...
En pratique
Les 10 commandements dans le diagnostic et la prise en charge des maladies du péricarde :
1. En cas de péricardite aiguë, l’hospitalisation est recommandée pour les patients à haut risque, ayant un facteur prédictif d’une cause spécifique (non virale ou non idiopathique) ou à risque élevé de complications (au moins 1 facteur parmi les suivants : fièvre > 38 °C, évolution subaiguë, épanchement péricardique abondant, tamponnade, absence de réponse aux AINS, myopéricardite, patient immunodéprimé, cause traumatique, traitement anticoagulant oral).
2. En cas de péricardite aiguë, la colchicine est recommandée en première intention, en association avec l’aspirine et les AINS.
3. La ponction péricardique ou le drainage chirurgical sont indiqués en cas de tamponnade, ou en cas d’épanchement péricardique d’abondance moyenne ou importante (décollement péricardique diastolique > 20 mm en échocardiographie), avec persistance des symptômes sous traitement médical, et en cas de suspicion d’une cause bactérienne ou néoplasique.
4. Le principal traitement de la constriction péricardique permanente est la péricardectomie chirurgicale.
5. Une démarche diagnostique complète doit être entreprise pour les causes nécessitant une thérapie ciblée. La prise en charge moderne des maladies du péricarde doit inclure les marqueurs biologiques et les différentes modalités d’imagerie cardiaque.
6. La sérologie virale n’est pas recommandée en routine dans la péricardite aiguë, à l’exception des virus HIV et HCV. Pour le diagnostic de certitude de péricardite virale, une étude complète histologique, cytologique, immunohistologique, et biochimique moléculaire du liquide péricardique doit être effectuée. En l’absence de ces éléments, le terme « péricardite virale présumée » doit être utilisé.
7. Pour les patients ne vivant pas dans des zones endémiques, le traitement antituberculeux empirique n’est pas recommandé lorsque les investigations complémentaires systématiques n’ont pas confirmé le diagnostic de péricardite tuberculeuse. En revanche, pour les patients vivant en zones endémiques, le traitement antituberculeux empirique est recommandé en cas d’épanchement péricardique exsudatif, après avoir éliminé les autres causes.
8. En cas d’épanchement purulent, le drainage péricardique est recommandé, en association avec les antibiotiques admi - nistrés par voie intraveineuse.
9. Les analyses cytologiques du liquide péricardique sont recommandées pour confirmer une cause néoplasique. Les biopsies du péricarde ou de l’épicarde doivent être envisagées pour confirmer cette étiologie.
10. L’aspirine n’est pas recommandée dans le traitement de la péricardite aiguë chez l’enfant ; les AINS sont le traitement de première intention.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :