Publié le 02 mai 2017Lecture 10 min
Quel bilan étiologique face à un infarctus cérébral chez un sujet jeune ?
Pauline RENOU, Igor SIBON, François ROUANET, Unité neurovasculaire, Pôle des neurosciences cliniques, CHU de Bordeaux

Identifier l’étiologie d’un infarctus cérébral (IC) est primordial afin d’évaluer le risque de récidive et d’adapter le traitement de prévention secondaire. Comme à tout âge, les causes d’IC se distribuent entre complications d’athérosclérose, cardiopathies emboligènes, occlusion des petits vaisseaux intracérébraux, autres causes identifiées et causes inconnues.
Cependant, chez le sujet jeune (par convention moins de 55 ans), la fréquence respective de ces différentes étiologies diffère du sujet âgé : les IC d’origine athéromateuse sont moins fréquents alors que les autres causes telles que les dissections des vaisseaux du cou le sont beaucoup plus (figure 1)(1). Environ un tiers des IC des sujets jeunes demeurent de cause indéterminée malgré un bilan étiologique approfondi(2). Il existe, par ailleurs, des facteurs de risque spécifiques à cette tranche d’âge tels que : grossesse, contraception orale et consommation de toxiques, alors que les facteurs de risque traditionnels comme l’HTA, le diabète et le cholestérol sont moins fréquents. Enfin, les pathologies non vasculaires du système nerveux central, telles que migraines avec aura, sclérose en plaques, manifestations conversives et crises d’épilepsie mimant la symptomatologie d’un IC sont plus fréquemment rencontrés chez le sujet jeune. Ainsi, les IC du sujet jeune requièrent une approche diagnostique particulière(3-4).
Figure 1. Fréquence des étiologies d’infarctus cérébral chez le sujet jeune dans les études, adapté de Ferro et al.(1). A : fréquence des étiologies selon la classification TOAST. B : fréquence des pathologies classées dans le sous-type « cause indéterminée » de la classification TOAST.
Imagerie cérébrale et vasculaire
Imagerie cérébrale
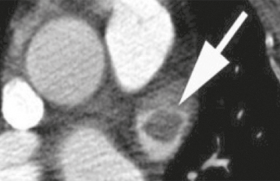
Elle permet tout d’abord d’éliminer un diagnostic différentiel. Une fois le diagnostic d’IC confirmé, la localisation, l’étendue et le nombre de lésions ischémiques pourra fournir des arguments en faveur d’une étiologie. Ainsi, des infarctus multiples plutôt volumineux dans des territoires artériels différents avec transformation hémorragique font évoquer un mécanisme cardioembolique. Des infarctus multiples dans un même territoire artériel ou dans un territoire artériel jonctionnel orientent vers une lésion artérielle cervicale, notamment une dissection chez un sujet jeune (figure 2). Des infarctus multiples de petite taille, d’âge différent et associés à des microbleeds (microsaignements) sont plutôt en faveur d’une maladie des petits vaisseaux.
Les deux examens d’imagerie du parenchyme cérébral utilisés en routine clinique sont le scanner et l’IRM cérébrale. Du fait de la multiplicité de ses séquences, l’IRM procure des informations étiologiques primordiales et est donc l’examen de référence pour le bilan étiologique d’un IC(5). La séquence de diffusion (DWI : diffusion weighted imaging) permet de visualiser, dès la 30e minute postictale, les lésions ischémiques récentes, y compris de très petite taille, de localisation corticales, sous-corticale et de la fosse postérieure, avec une très bonne sensibilité(6). Couplée au calcul du coefficient apparent de diffusion (ADC), elle permet de dater la ou les lésions ichémiques récentes. La séquence Flair (fluid attenuated inversion recovery) est très sensible pour détecter les lésions vasculaires subaiguës et chroniques ainsi que la leucoencéphalopathie, cette dernière témoignant d’une maladie chronique des petits vaisseaux. La dernière séquence indispensable au bilan parenchymateux est le T2* (ou écho de gradient T2) : très sensible aux produits de dégradation de l’hémoglobine, cette séquence a une sensibilité identique au scanner pour détecter les hémorragies aiguës mais est nettement supérieure pour la détection des hémorragies chroniques, des microbleeds et des transformations hémorragiques(7).
Figure 2. Infarctus cérébral jonctionnel secondaire à une dissection carotidienne, adapté de Renou et al.(4). A : séquence de diffusion DWI : infarctus récent dans le territoire jonctionnel des artères cérébrales antérieur et moyenne droites. B : ARM des TSA : sténose « en flamme de bougie » située 1 cm au-dessus du bulbe carotidien droit, évocateur de dissection. C : IRM axiale cervicale en séquence T1 avec saturation des graisses confirmant le diagnostic de dissection carotidienne: hématome de paroi élargissant le calibre de la carotide et apparaissant sous la forme d’un croissant périphérique en hypersignal T1.
Imagerie vasculaire
L’objectif est de rechercher des aspects évocateurs de dissection, sténose athéromateuse, vasospasme ou maladie des petits vaisseaux intracrâniens. Quatre modalités d’exploration des vaisseaux cervicaux et intracrâniens existent : l’angioscanner, l’angio-IRM (ARM), l’écho-Doppler et l’angiographie conventionnelle. Le choix parmi ces différentes modalités devra prendre en compte leurs avantages-inconvénients, leur fiabilité variable en fonction de l’étiologie ou du siège de la pathologie recherchée, leurs contre-indications et leur accessibilité différente selon les centres hospitaliers.
L’angioscanner est d’acquisition très rapide, avec une très bonne résolution spatiale mais est invasif du fait de l’irradiation et de la nécessité d’injecter un produit de contraste iodé limitant ses indications, notamment chez les femmes enceintes, les patients diabétiques, allergiques ou insuffisant rénaux. L’angio-IRM a l’avantage d’être moins invasive mais avec une moins bonne résolution spatiale. L’écho-Doppler est non invasif, peut être répété facilement, notamment au lit du patient, mais reste opérateur et patient dépendant avec une résolution spatiale parfois limitée. L’angiographie, du fait de son caractère invasif est un examen de dernière intention.
Pour le diagnostic de dissection cervicale, l’association IRM-ARM est l’examen de référence. L’IRM cervicale en T1 avec suppression des graisses permet de visualiser l’hématome de paroi au stade subaigu (figure 2, C)(8). Cependant, il existe des faux négatifs notamment pour les dissections vertébrales basses situées en raison des artéfacts de mouvement respiratoires et pulsatiles aortiques, l’angio-TDM devenant alors plus pertinent. L’écho-Doppler ne montre souvent que des signes indirects de dissection, nécessitant une confirmation par une autre méthode d’imagerie(9). L’angiographie conventionnelle n’est pratiquée qu’en cas de diagnostic incertain après la réalisation des examens non invasifs.
Pour le diagnostic de sténose athéromateuse cervicale, l’ARM des TSA injectée est l’examen de référence, en particulier pour les sténoses carotidiennes(10).
Pour le diagnostic de maladie des petits vaisseaux intracrâniens, l’ARM, notamment la séquence TOF (time of flight) qui ne requiert pas d’injection de gadolinium, ainsi que l’écho-Doppler transcrânien sont deux méthodes non invasives et fiables pour détecter les sténoses secondaires à une athéromatose intracrânienne(11) ou à une angéite, ainsi que les vasospasmes rencontrés dans les syndromes de vasoconstriction réversible(2). L’angiographie ne sera, là encore, réalisée qu’en dernière intention en cas de doute diagnostique.
En cas de suspicion d’embolie paradoxale, la recherche d’un shunt droit-gauche d’origine cardiaque ou pulmonaire peut être réalisée par Doppler transcrânien couplé à une épreuve de contraste. Un écho-Doppler veineux des membres inférieurs est également réalisé à la recherche d’une thrombose veineuse périphérique.
Explorations cardiologiques
L’objectif des explorations cardiologiques est d’identifier une pathologie rythmique ou morphologique cardiaque associée à un risque emboligène élevé.
L’ECG standard doit être réalisé systématiquement à l’admission pour identifier une pathologie cardiaque, notamment ischémique, qui a précédé ou est concomitante à l’IC, mais surtout pour rechercher une fibrillation auriculaire (FA). Cependant, 30 % des FA responsables d’IC sont paroxystiques, et donc non détectées par l’ECG standard. Ainsi, un monitoring cardiaque d’au moins 24 h pour les patients hospitalisés est recommandé(12). Un patient sortant d’hospitalisation et sans étiologie retrouvée doit bénéficier d’un monitoring cardiaque ambulatoire. Plus l’enregistrement du rythme cardiaque est prolongé, plus les chances de détection de FA augmentent. Ainsi, le Holter-ECG sur 24 h permet de détecter 5 % de FA supplémentaires(13) et un monitoring sur 7 jours augmente encore ce rendement de 6 %(14). D’autres dispositifs ambulatoires prometteurs non invasifs(15) ou implantables(16) sont à ce jour en cours d’évaluation.
Bien qu’invasive, l’échographie cardiaque transœsophagienne (ETO) doit être réalisée, en l’absence de pathologie évidente sur l’échographie cardiaque transthoracique (ETT), pour tout IC du sujet jeune sans étiologie retrouvée sur le bilan de première intention. L’ETO est en effet plus sensible que l’ETT en particulier pour rechercher une végétation sur la valve mitrale, un thrombus dans l’oreillette gauche, une anomalie du septum interauriculaire, une tumeur intracardiaque telle que myxome ou fibro-élastome, et de l’athérome sur la crosse aortique(17). Il est à noter que si la recherche d’un foramen ovale perméable et d’un anévrisme du septum interauriculaire est systématiquement réalisée, leur imputabilité dans l’IC n’est à ce jour pas démontrée(18).
Bilan biologique
Certains examens biologiques doivent être réalisés en première intention devant un IC (figure 3) car ils permettent de dépister certaines étiologies ou facteurs de risques vasculaires. Ainsi, une CRP élevée peut orienter vers une étiologie infectieuse (ex: endocardite) ou inflammatoire (ex : angéite). Une perturbation de l’hémostase fait rechercher une thrombophilie. Un bilan lipidique perturbé ou une hyperglycémie évoquant un diabète orientent vers une piste athéromateuse. La consommation de stupéfiants, responsable entre autres de vasospasmes, est une étiologie de plus en plus fréquente d’IC du sujet jeune(19). La recherche de toxiques sanguins et urinaires (cannabis, cocaïne, amphétamines et opiacés) doit donc être réalisée en première intention et sans délai.
Certains autres examens sont réalisés en seconde intention selon le contexte : sérologies VIH(20) et syphilitique en cas d’exposition au risque et après accord du patient, bilan immunologique en cas de suspicion clinique ou biologique d’angéite auto-immune, électrophorèse de l’hémoglobine en cas de facteurs ethniques prédisposants. Une élévation importante des D-dimères doit faire évoquer une coagulation intravasculaire disséminée ou une néoplasie.
Enfin, d’autres examens sont réalisés plus rarement, tels que le dosage des lactates et pyruvates en cas de suspicion de mitochondriopathie. L’hyperhomocystéinémie n’étant pas une cause mais un facteur de risque d’IC par dysfonction endothéliale pouvant générer athérosclérose et dissections, son dosage peut être proposé en 3e intention, notamment en cas d’athérosclérose sans facteur de risque identifié, ou de dissections idiopathiques itératives.
La ponction lombaire doit être réalisée en seconde intention et à distance de l’IC, en cas de suspicion d’angéite cérébrale. Cependant, ses résultats sont à interpréter avec précaution car une réaction cellulaire modérée est habituelle au décours d’un IC.
La recherche de thrombophilie ne doit pas être systématique. Le syndrome des antiphospholipides (SAPL) est une thrombophilie acquise responsable d’IC par thrombose in situ ou vasculopathie cérébrale dans le cadre d’un lupus. Le dosage des anticorps antiphospholipides (anticardiolipines, anticoagulant circulant lupique, antibéta2gp1) est donc réalisé en seconde intention avec une suspicion d’autant plus forte qu’il existe un allongement spontané du TCA ou des antécédents de thromboses artérielles veineuses, de fausses couches et de livedo reticularis. Un résultat négatif doit être contrôlé à distance. Le diagnostic de SAPL n’est en effet retenu qu’après la répétition de l’analyse 12 semaines plus tard. Les thrombophilies héréditaires étant reconnues comme facteur de risque de thrombose veineuse, mais non artérielle, leur recherche n’est proposée qu’en cas d’antécédents personnels ou familiaux de thromboses veineuses répétées afin de prévenir leur récidive, mais elles ne peuvent être retenues comme cause de l’IC(21).
Figure 3. Démarche diagnostique pour le bilan étiologique d’infarctus cérébral du sujet jeune, adapté de Renou et al.(4). * Numération formule sanguine et plaquettes, glycémie, ionogramme, CRP, TP, TCA, fibrinogène, troponine, bilan lipidique (LDL, HDL, triglycérides), créatinine, bilan hépatique, toxiques sanguins et urinaires (cannabis, cocaïne, amphétamines, opiacés). † Anticorps antinucléaires, anti-SSA, anti-SSB, antiSm, c-ANCA, p-ANCA, complément, facteur rhumatoïde, cryoglobuline, électrophorèse et immuno-électrophorèse des protéines sériques, enzyme de conversion. ‡ Syndrome des antiphospholipides : Anticorps anticardiolipine, anti-béta2gp1, anticoagulant circulant lupique.
Bilan génétique
Il existe des formes rares d’IC héréditaires monogéniques qui ne sont recherchées qu’en troisième intention et en cas de suspicion clinique, radiologique ou d’histoire familiale évocatrice, afin de proposer un conseil génétique et des attitudes thérapeutiques préventives(22). CADASIL (Cerebral Autosomic Dominant Arteriopathy with Subcortical Infarcts and Leucoencephalopathy) est la maladie génétique la plus fréquemment associée aux IC. Autosomique dominante, son diagnostic se fait par l’identification de la mutation du gène NOTCH3. La maladie de Fabry est une maladie métabolique liée à l’X responsable d’une vasculopathie. Son diagnostic se fait par le dosage de l’activité enzymatique de l’alpha-galactosidase. Le syndrome de MELAS associe myopathie mitochondriale, encéphalopathie, acidose lactique et des tableaux neurologiques aigus ressemblant à des accidents ischémiques cérébraux (stroke-like). Son diagnostic est réalisé par biopsie musculaire, qui montre des fibres rouges déchiquetées (ragged-red fibers) et un déficit mosaïque en activité cytochrome oxydase, ainsi que la recherche de la mutation causale sur biopsie ou dans le sang.
Biopsies
Une biopsie cutanée peut être réalisée en cas de livedo reticularis et suspicion de syndrome de Sneddon. La biopsie musculaire est indiquée en cas de suspicion de syndrome de MELAS. Une biopsie cérébrale et leptoméningée est proposée, en l’absence de possibilité de biopsie d’autre tissu plus facilement accessible, en cas de suspicion clinique d’angéite cérébrale et en l’absence d’éléments paracliniques confirmant cette hypothèse.
Conclusion
Le bilan étiologique d’IC chez le sujet jeune est rendu complexe par la multiplicité mais également la disparité des pathologies sous-jacentes à rechercher. Cependant, un choix séquentiel parmi les nombreux examens complémentaires disponibles doit être réalisé afin d’optimiser le rendement de ce bilan, d’en réduire le coût et l’invasivité pour le patient.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité