Valvulopathies
Publié le 12 juin 2012Lecture 6 min
Rétrécissement aortique à haut risque

Deux modalités de traitement du rétrécissement aortique sont aujourd’hui possibles, la chirurgie classique et l’implantation par voie percutanée. Cette dernière a déjà repoussé les limites des possibilités de traitement chez les patients très âgés et à haut risque chirurgical. Les résultats de la chirurgie, en particulier de la chirurgie valvulaire aortique avec implantation de bioprothèses, sont plutôt bons avec une mortalité à 30 jours de 5,5 % pour le remplacement valvulaire aortique isolé et une survie à 15 ans de 25 % ! Ceux du TAVI ont notablement progressé et devraient encore s’améliorer avec l’expérience acquise et les progrès techniques.
Chirurgie de l’octogénaire : quelles limites ?
D’après A. Leguerrier (Rennes)
A. Leguerrier et coll. ont analysé rétrospectivement à partir de la base de données de chirurgie cardiaque du CHU de Rennes, 1 193 remplacements valvulaires aortiques consécutifs effectués chez des patients de plus de 80 ans depuis 2000 : 55 % des patients avaient au moins une comorbidité (broncho-pneumopathie chronique obstructive ou insuffisance rénale) ; 32 % avaient des lésions coronaires associées au rétrécissement valvulaire aortique. Dans seulement 74 % des cas, seule la valve aortique a été remplacée ; dans tous les autres cas, il a été pratiqué une autre chirurgie, essentiellement des pontages aorto-coronaires. La mortalité opératoire est globalement de 6,9 % et de 5,5 % seulement pour le remplacement valvulaire aortique isolé. Plusieurs facteurs sont associés à un sur-risque : l’avance en âge (p < 0,015) ; l’insuffisance respiratoire (p < 0,03) ; la fuite aortique (p < 0,001) ; la chirurgie non programmée (p < 0,0029) ; la classe NYHA IV (p < 0,0007) ; la dysfonction ventriculaire droite (p < 0,03) ; la fibrillation atriale (p < 0,04) ; la dysfonction ventriculaire gauche (p < 0,001) ; la coronaropathie associée (p < 0,01) ; la chirurgie redux (p < 0,02) ; la chirurgie de pontage nécessaire en complément du remplacement valvulaire aortique (p < 0,008).
On peut donc retenir que la chirurgie de remplacement valvulaire aortique reste une option thérapeutique envisageable pour les patients âgés de plus de 80 ans ; toutefois, la présence de comorbidités et d’antécédents de chirurgie cardiaque doit certainement orienter vers une autre option, la valve implantée par voie percutanée (TAVI).
Le TAVI a montré des résultats très encourageants dans les études PARTNER A et B à 1 an puis à 2 ans. Il en est de même dans les registres ; le plus grand, France 2, publié par Pr Gilard dans le New England Journal of Medicine il y a quelques semaines, témoigne des bons résultats de la voie percutanée du traitement des sténoses aortiques pour les patients à trop haut risque récusés pour la chirurgie.
Retenons à ce stade, que si l’âge compte, il n’est pas suffisant à lui seul. Il faudra également recourir au traitement percutané de la sténose aortique dans le cas de thorax hostile (après radiothérapie thoracique par exemple). Retenons aussi, qu’il sera de plus en plus possible de traiter les dégénérescences de bioprothèses par le « valve-invalve » mais cette procédure ne concerne encore, selon A. Leguerrier, qu’un nombre très restreint de patients.
Quels examens d’imagerie avant de planifier un TAVI ?
D’après E. Brochet (hôpital Bichat, Paris)
Le maître-mot est clairement : multi-modalité
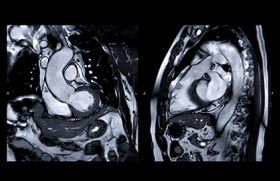
Il est nécessaire d’apprécier précisément la sévérité de la valvulopathie et de vérifier que la valvulopathie est bien responsable de la symptomatologie fonctionnelle. L’échocardiographie doit être rigoureuse. Elle doit permettre de bien quantifier la sténose, de vérifier que la valve aortique est tricuspide, que l’aorte ne soit pas trop large, que la chambre de chasse n’est pas trop réduite par un bourrelet sous-aortique, par une coudure septale qui serait responsable d’une obstruction intraventriculaire gauche. Elle doit bien sûr vérifier la valve mitrale et le niveau de pression pulmonaire.
Le diagnostic de la bicuspidie n’est pas toujours aisé. À cet égard, le scanner peut être contributif, en particulier sur ces valves très calcifiées. Il faut aussi savoir recourir à l’échocardiographie transœsophagienne.
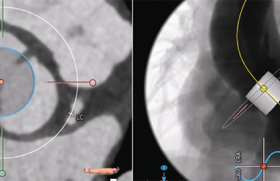
L’échocardiographie transœsophagienne peut être d’une aide précieuse pour mesurer l’anneau aortique, exclure la présence d’un thrombus intracavitaire, en complétant les renseignements fournis par l’échocardiographie transthoracique et le scanner sur ces points. Il faudra juste rechercher les discordances entre ces examens, essayer d’en comprendre les causes pour, in fine, planifier au mieux la pose de la prothèse et éviter un sous-dimensionnement de la prothèse, source de fuites paraprothétiques, ou au contraire un surdimensionnement de la prothèse avec un risque de rupture de l’anneau aortique (figure).
L’analyse de l’anneau aortique, de la morphologie de la valve (éliminer une bicuspidie) tire bénéfice de l’échocardiographie où il est possible d’analyser un plan et le plan orthogonal sur le même cycle.
La mesure de l’anneau aortique est délicate. En effet, ce que nous souhaitons mesurer est un anneau virtuel, qui n’est donc pas une réelle structure anatomique, correspondant à la base d’implantation des sigmoïdes aortiques. L’échocardiographie transthoracique et l’échocardiographie transœsophagienne sont supposées donner des valeurs très proches, mais la mesure n’est pas facile ; il faut accepter une courbe d’apprentissage et une confrontation au scanner.
À ce jour, le choix de la prothèse à implanter repose toujours sur la mesure des diamètres de l’anneau aortique. Or, nous savons que l’orifice n’est pas toujours, loin s’en faut, parfaitement circulaire (elliptique dans 60 % des cas). De fait, certains ont proposé de mesurer, en scanner ou en échocardiographie 3D, la surface de l’anneau. Même si cette mesure paraît plus logique, elle n’a pas encore d’impact réel en pratique.
L’imagerie a un rôle majeur pour planifier la pose d’une valve aortique par voie percutanée. Il faut toutefois reconnaître qu’il n’existe pas de technique d’imagerie idéale. Les techniques doivent être combinées. Chaque centre doit continuer à développer son expérience et à travailler sur cette continuité aortoventriculaire, ce site particulier mal défini anatomiquement où nous souhaitons implanter la prothèse, en sachant qu’il faudra choisir entre des prothèses ayant des caractéristiques techniques différentes (Edwards Sapien XT ou CoreValve actuellement).
Résultats à long terme et perspectives du TAVI
D’après J.-L. Monin (Paris)
Le registre France-2 rapporte l’activité des implantations de valves aortiques par voie percutanée en France. Dans ce registre incluant 3 195 patients, chez lesquels une prothèse Edwards-Sapien a été implantée dans 70 % des cas, les résultats sont concordants avec ceux des autres séries. La mortalité à 30 jours est de 9,7 % et à un an de 24 %.
L’étude PARTNER B a permis de confirmer que le traitement médical, même quand il est associé à des procédures de valvuloplastie de la valve aortique, est associé à une mortalité de 62,4 %. La valvuloplastie ne modifie pas l’histoire naturelle de la valvulopathie aortique et ne peut être proposée que dans des situations de sauvetage pour se donner le temps de décider ou non de la pose d’une valve aortique par voie percutanée ou pour tester la capacité de récupération ventriculaire gauche en complément de l’échocardiographie dobutamine de viabilité.
Les résultats à 2 ans sont incontestablement encourageants dans PARTNER à 1 et 2 ans comme dans les registres. Le sur-risque d’accident vasculaire cérébral, suggéré dans les résultats à 1 an de l’étude PARTNER, n’est pas confirmé ; certes, on observe davantage d’accidents transitoires, mais le risque d’accident vasculaire cérébral constitué avec séquelle fonctionnelle est non significatif. Dans France-2 (âge moyen 84 ans, Euroscore 30 %), l’incidence des accidents vasculaires cérébraux à 1 an est de 4,1 %.
En revanche, l’étude PARTNER comme les registres, dont France 2, montrent une surmortalité associée aux régurgitations aortiques périprothétiques.
Une augmentation de la mortalité est, en effet, observée pour les fuites significatives (> 2/4). Dans le registre France-2, le taux de régurgitations périprothétiques est de 64,5 %. Cependant, grâce aux progrès réalisés depuis 2 ou 3 ans, l’incidence des fuites paraprothétiques est en baisse. Cette forte incidence devrait toutefois inciter à améliorer les connaissances de la racine aortique et devrait diminuer grâce aux progrès techniques. Ces fuites aortiques sont difficiles à quantifier, les techniques classiques de quantification des régurgitations valvulaires n’étant pas adaptées. L’effet télédiastolique dans l’isthme est sans doute une technique à appliquer chez chaque patient. Une autre question qui se pose quotidiennement est de déterminer quels sont les patients à qui proposer ou ne pas proposer la technique. Les « Euroscore » les plus élevés et les classes NYHA les plus hautes ressortent comme fortement corrélés au pronostic en analyse multivariée dans le registre France-2. D’où l’importance de l’évaluation préopératoire du degré de fragilité du patient et de ses comorbidités. C’est dire la place essentielle de l’évaluation gériatrique réalisée en complément de l’évaluation cardiologique pour essayer de mieux identifier les patients qui tireront bénéfice de l’implantation d’une valve de ceux qui n’en tireront aucun bénéfice et dont le pronostic est mauvais, indépendamment de la valvulopathie aortique.
Enfin, pour conclure retenons qu’il faut traiter 5 patients pour sauver une vie selon la base des résultats actuels !
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :