Publié le 13 mai 2008Lecture 6 min
Thrombose intracardiaque révélatrice d'un syndrome des anticorps antiphospholipides
S. BOUZIDI BELMAJDOUB, M. LAZRAQ, T.-M. ALAOUI, Y. BOUBKRAOUI, J. ZARZUR, M. ARHARBI et M. JIRA, A. ABDOU, Rabat

Le syndrome des anticorps antiphospholipides (SAPL) est une entité clinique se caractérisant par la présence permanente dans le sang d’anticorps antiphospholipides (anticorps anticardiolipine ou anticoagulant lupique) responsables de phénomènes thrombotiques artériels et/ou veineux. L’atteinte cardiaque constitue l’une des manifestations les moins fréquentes du syndrome. De ce fait, nous rapportons le cas d’une jeune patiente ayant présenté une thrombose intracardiaque révélatrice d’un syndrome des anticorps antiphospholipides.
Observation
La patiente J.F, âgée de 19 ans, sans antécédents particuliers, avait été admise dans le service de cardiologie pour prise en charge d’une fièvre du post-partum associée à une dyspnée stade II de la NYHA. Cette symptomatologie s’était associée à des arthralgies, céphalées et sueurs. À l’admission, la patiente était fébrile à 38°, eupnéïque au repos. Les conjonctives étaient normalement colorées. La tension artérielle était à 100/60 mmHg. L’examen cardiovasculaire avait trouvé un souffle systolique d’insuffisance mitrale (3/6e) irradiant à l’aisselle gauche avec un éclat de B2 pulmonaire. Les pouls périphériques étaient tous présents et symétriques.
L’électrocardiogramme (figure 1) avait inscrit un rythme régulier sinusal, un hémibloc antérosupérieur gauche, une fréquence cardiaque à 100 bpm/ min et un aspect QS en antérieur.
Figure 1. ECG lors de la 1re hospitalisation montrant un infarctus antérieur étendu du myocarde.
La radiographie pulmonaire (figure 2) avait objectivé une cardiomégalie V1 avec un rapport cardio-thoracique à 0,54, une surcharge hilaire bilatérale et un débord de l’arc inférieur droit. Devant ce contexte clinique, une endocardite infectieuse a été soupçonnée. Des hémocultures réalisées étaient revenues négatives. Le bilan inflammatoire était perturbé avec une vitesse de sédimentation (VS) à 43 mm, une CRP à 28 mg/l. La numération formule sanguine notait une hyperleucocytose à 14 810, une anémie modérée à 11,2 g/l d’allure inflammatoire et une thrombocytose à 691 000. Le ionogramme sanguin était normal. La protéinurie était négative. Le bilan effectué à la recherche d’une porte d’entrée infectieuse comportait un examen cytobactériologique des urines, en plus des examens gynécologique, buccodentaire et ORL. Ces derniers étaient sans particularités.
Figure 2. Radiographie pulmonaire réalisée lors de la 1re hospitalisation.
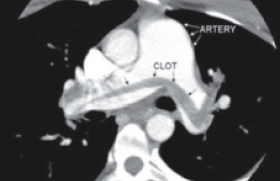
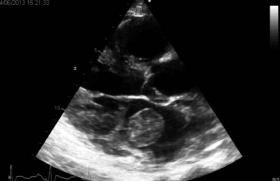
L’échographie cardiaque transthoracique (ETT) (figure 3) avait trouvé une masse échogène, mobile, mesurant 22 mm de longueur adhérant au bout distal du versant auriculaire de la grande valve mitrale. La valve mitrale était fine sans anomalie évidente. Par ailleurs, l’ETT avait permis de découvrir un ventricule gauche dilaté avec un diamètre télédiastolique à 68 mm et une akinésie de la paroi antéroseptale. Les autres parois se contractaient normalement. Au Doppler, il existait une insuffisance mitrale minime. Le caractère apparemment sain des valves mitrales et la négativité des hémocultures avaient évoqué la possibilité d’un fibroélastome ou encore d’un thrombus intracardiaque compliqué d’une embolie coronarienne. Parallèlement, un bilan de thrombophilie n’avait pas montré de déficit constitutionnel en antithrombine, ni en protéine C ni en protéine S. Les anticorps anticardiolipines étaient négatifs. En revanche, l’anticoagulant lupique était positif sur deux dosages différents réalisés à 6 semaines d’intervalle. Le TCA était allongé spontanément à 40/30 s. Une coronarographie (figure 5) réalisée avait mis en évidence une sténose longue de l’interventriculaire antérieure moyenne sur un réseau coronarien sain. Le syndrome des anticorps antiphospholipides avait été retenu. La patiente avait été mise sous anticoagulants (héparine en relais avec les AVK visant un INR entre 3 et 4), sous inhibiteur de l’enzyme de conversion, en plus d’un bêtabloquant. En cours d’hospitalisation, le suivi avait permis de découvrir l’abolition des pouls pédieux. Un écho-Doppler réalisé avait mis en évidence une embolie de l’artère poplitée gauche. Par ailleurs, un scanner cérébral systématique avait révélé la présence d’une zone d’ischémie dans la région insulaire gauche.
Le contrôle échographique (figure 4) a montré la régression de la taille de la masse avec persistance d’un petit nodule hyperdense au bout distal de la grande valve.
L’évolution à long terme a été marquée par la survenue de deux poussées d’insuffisance cardiaque globale ayant nécessité des hospitalisations itératives. Actuellement, l’état clinique de notre patiente est stable sous traitement symptomatique.
Figure 3. Echographie cardiaque transthoracique lors de la 1re hospitalisation montrant une thrombose intracardiaque (1er Avril 2005).
Figure 4. Echographie cardiaque transthoracique réalisée un mois plus tard montrant la régression de la dimension de la masse.
Figure 5. Image coronarographique montrant la sténose longue de l’artère coronaire interventriculaire antérieure (serrée à 50%).
Discussion
Les présentations cliniques du SAPL sont multiples. Les plus fréquentes sont les avortements à répétition et les accidents vasculaires cérébraux. L’affection cardiaque reste moins fréquente et constitue la cause la plus commune de morbidité et de mortalité du syndrome.
Les manifestations cardiaques au cours du SAPL ont été décrites pour la première fois par Kaplan et al en 1992(3).
Les plus fréquentes sont représentées essentiellement par les lésions valvulaires à type de masses ou végétations (endocardite non infectieuse de Libman-Sacks), d’épaississement diffus des valves sans restriction des mouvements avec dysfonction valvulaire (insuffisance valvulaire ou rarement une sténose valvulaire). Ces lésions hétérogènes spécifiques concernent presque exclusivement le cœur gauche(2). L’atteinte mitrale constitue 60 % des valvulopathies acquises au cours du SAPL. Une authentique greffe bactérienne est toujours possible sur les lésions valvulaires du SAPL(2).
Si des thromboses artérielles ou veineuses périphériques sont fréquentes dans le SAPL, les thromboses intracardiaques sont plus rarement décrites. La localisation préférentielle est auriculaire droite. Par ailleurs, contrairement aux thromboses intracardiaques sur prothèse valvulaire ou valve native lésée, les thromboses sur structures valvulaires normales sont peu rapportées. La prévalence de ces dernières est souvent sous-estimée lorsque l’anticoagulation est administrée précocement(3).
Les thromboses intracardiaques posent souvent un problème de diagnostic différentiel à l’échographie cardiaque(4). En effet, chez notre patiente, la végétation oslérienne a été évoquée puis écartée devant la négativité des hémocultures et l’absence de porte d’entrée infectieuse. Les tumeurs bénignes ont également été soupçonnées, en l’occurrence le fibroélastome. En effet, celui-ci apparaît souvent sur les valves cardiaques mais aussi sur l’endocarde et possède un haut potentiel emboligène(4). L’éventualité de ce diagnostic a été éliminée devant la positivité de l’anticoagulant lupique et la présence de l’atteinte coronaire. L’éventualité de l’atteinte cardiaque demeurait donc la plus probable. Selon Shortell, le SAPL doit être suspecté chez le sujet jeune, en particulier de sexe féminin, non fumeur et présentant des anomalies vasculaires atteignant essentiellement les extrémités supérieures, les vaisseaux cérébraux avec une angiographie carotidienne normale(5).
Chez notre patiente, le syndrome des anticorps antiphospholipides a été évoqué devant la présence à l’échographie de la thrombose intracardiaque associée aux événements thromboemboliques. Le syndrome a été retenu devant la présence d’anticoagulants lupiques qui est un critère biologique majeur, attesté par l’allongement du temps de céphaline activée (TCA) et l’absence d’autre coagulopathie. L’absence des anticorps anticardiolipines n’élimine pas le diagnostic puisque 20 à 30 % des patients atteints du SAPL ont un anticoagulant circulant positif et des anticorps anticardiolipines négatifs(1). Par ailleurs, la positivité de l’anticoagulant circulant présente un risque majeur d’accidents thromboemboliques beaucoup plus important que celui d’un anticorps anticardiolipines isolément positif. Chez notre patiente, la survenue ultérieure des complications emboliques (oblitération de l’artère poplitée gauche, accident vasculaire cérébral ischémique) malgré le traitement anticoagulant confirme le caractère hautement thrombogène des anticorps antiphospholipides. De plus, selon Wolfgang Miesbach, les patients porteurs du SAPL associé à une CRP élevée déterminent un groupe à haut risque de développer un accident vasculaire cérébral(6).
Par ailleurs, la cardiopathie ischémique est une manifestation du SAPL. Récemment, des taux élevés d’anticorps antiphospholipides ont été découverts chez des patients âgés de moins de 30 ans, ayant présenté un infarctus du myocarde(2). Les anticorps antiphospholipides constituent un facteur de risque élevé de complications cardiovasculaires (occlusion artérielle, récidive d’infarctus, maladie thromboembolique), ce qui justifie pour certains la prescription prolongée d’un traitement anticoagulant ou d’aspirine à faible dose(7). Chez notre patiente, l’aspect coronarographique suggère une atteinte coronaire spécifique du syndrome des anticorps antiphospholipides plutôt qu’une atteinte embolique. En effet, les anticorps antiphospholipides contribuent également à l’accélération des processus d’athérosclérose au niveau des artères indépendamment de toute dyslipidémie selon Nityanand(8, 9, 10).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité