Paramédical
Publié le 20 juin 2019Lecture 8 min
Le traitement percutané de la fibrillation atriale
P. GUILLAUME, IDE, CHU de Grenoble
La fibrillation atriale (FA) est le trouble du rythme le plus fréquent ; elle atteint 1 % de la population et 10 % des plus de 80 ans(1). Si elle n’est pas traitée, elle peut entraîner de graves complications telles qu’un accident vasculaire cérébral ou une insuffisance cardiaque.
D’une mécanique complexe, ce n’est que très récemment que les techniques d’ablation permettant de la réduire ont été développées. Aujourd’hui, l’isolation des veines pulmonaires par cryoablation ou par radiofréquence fait partie de notre quotidien.
Comment fonctionnent ces deux techniques ? Et sont-elles équivalentes ?
Qu'est-ce que la FA ?
La FA est un trouble du rythme des oreillettes cardiaques. Elle se caractérise par la contraction anarchique de l’ensemble des cellules atriales, entraînant le ventricule à un rythme irrégulier. Elle est déclenchée, dans une majorité de cas, par des foyers ectopiques se situant à l’ostium des veines pulmonaires (figure 1). À l’ECG, cela se traduit par une absence d’onde P, une trémulation de la ligne de base et une fréquence des QRS irrégulière et souvent rapide, de 110 à 140 batt/min. Si la FA peut être suspectée cliniquement par une fatigue, des palpitations, une dyspnée, des douleurs thoraciques, elle s’avère souvent asymptomatique et seul l’ECG peut la caractériser.
Figure 1. Schéma du mécanisme de la FA – déclenchement de la FA par les foyers ectopiques et entretien par les ondelettes.
La FA est avant tout un effet du vieillissement cardiaque, mais aussi de l’évolution de la plupart des maladies du cœur (HTA, coronaropathies, valvulopathies, etc.). Elle peut également survenir chez des sujets jeunes sans aucune maladie cardiovasculaire sous-jacente, sans doute pour des raisons anatomiques génétiques et liées aux modes de vie. D’autres facteurs, comme l’obésité, l’apnée du sommeil, l’exercice physique intense, peuvent favoriser la survenue d’une FA.
Cette pathologie évolue avec le temps vers des crises de plus en plus prolongées. On définit trois stades de FA(2) :
• Paroxystique : crises de moins de 7 jours (généralement moins de 48 h) avec retour spontané à un rythme sinusal.
• Persistante : crises de plus de 7 jours avec cardioversion nécessaire pour rétablir un rythme sinusal.
• Permanente : crise de plus d’un an avec échec de cardioversion.
Conséquences pour le patient
La principale complication est l’accident vasculaire cérébral (AVC) : la contraction anarchique entraîne une mauvaise vidange des oreillettes et donc une stagnation du sang (particulièrement dans l’auricule gauche) qui peut alors coaguler.
Le rythme irrégulier des ventricules peut également engendrer de l’insuffisance cardiaque, allant de la simple fatigue ou dyspnée d’effort, jusqu’aux signes d’insuffisance cardiaque sévère.
Comment traiter la FA ?
Il convient avant tout de prévenir l’AVC.
Le patient sera traité par anticoagulants en fonction de son score CHA2DS2VASC(3), soit par un AOD (Xarelto®, Eliquis®, Pradaxa®) soit par une AVK en cas d’atteinte valvulaire.
Il faut ensuite ralentir le rythme cardiaque par un β-bloquant ou éventuellement des inhibiteurs calciques.
Il est enfin nécessaire de rétablir et maintenir un rythme sinusal. Ceci se fera au terme d’une anticoagulation minimale de 3 semaines : en première intention par un antiarythmique (Flécaïne, sotalol, amiodarone) et/ ou choc externe. En cas d’échec médicamenteux, on aura recours à l’isolation des veines pulmonaires, si la FA est symptomatique. Cependant, dans le cas de FA paroxystique symptomatique, l’isolation des veines pulmonaires pourra être proposée en première intention.
Comment isoler les veines pulmonaires ?
Il existe aujourd’hui deux techniques permettant d’isoler les veines pulmonaires : la cryoablation et la radiofréquence assistée par cartographie.
Bien que très différentes d’un point de vue technologique, elles sont comparables en termes de préparation.
Avant l’intervention
Après un traitement anticoagulant efficace (minimum 3 semaines), le patient bénéficie d’un scanner cardiaque afin de connaître l’anatomie de l’implantation des veines pulmonaires sur l’oreillette gauche.
Pendant l’intervention
• Le patient sera sous sédation profonde ou anesthésie générale suivant les équipes.
• Pour accéder à l’oreillette gauche, on effectuera, par un abord fémoral veineux, une ponction transseptale à l’aide d’une aiguille de Brockenbrough au niveau du foramen ovale, guidée ou non par échocardiographie transoesophagienne (ETO).
• Cette ponction sera maintenue ouverte par l’intermédiaire d’une gaine spécifique, permettant l’introduction de la sonde d’ablation et irriguée avec un sérum hépariné à 2 500 UI/500 ml.
• À cet instant on injectera, en IVD, un bolus d’héparine pour obtenir un temps de coagulation (ACT) entre 250 et 300 secondes, afin de prévenir la formation de thrombus.
L’isolation des veines peut alors débuter.
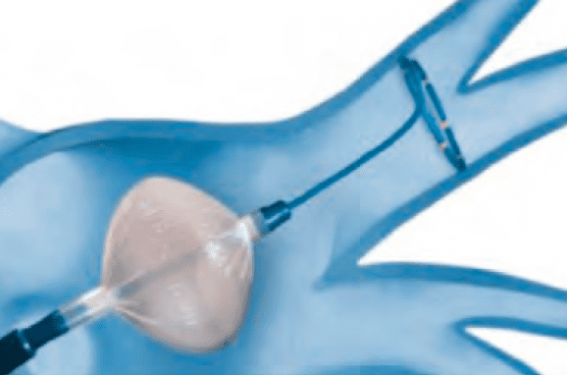
La technique de cryoablation
Le principe est de réaliser un anneau de nécrose électriquement isolant, en gelant les cellules de l’ostium des veines pulmonaires. Pour cela, on injecte du protoxyde d’azote à -70 °C sur la paroi interne d’un ballon luimême apposé à l’ostium de la veine. À l’heure actuelle, seule la société Medtronic commercialise cette technologie.
Le matériel comprend :
• une gaine orientable (FlexCath Advance™) : elle permet de guider le ballon jusqu’aux veines ;
• un ballon de cryothérapie (Artic Front Advance™) ;
• une console à laquelle est connecté le ballon par de 2 câbles spécifiques : un électrique et un coaxial pour le gaz ;
• un cathéter « lasso » (Achieve™) ;
• un cathéter diagnostique pour la stimulation du nerf phrénique.
L’isolation des veines se déroule en 4 étapes (figure 2) :
1. Recueil des potentiels à l’ostium de la veine à l’aide du cathéter lasso.
2. Inflation du cryoballon.
3. Positionnement et injection du froid :
• On injecte du produit de contraste au bout du ballon pour s’assurer que la veine est bien occluse. Si du sang circulait autour du ballon, il le réchaufferait, empêchant le froid d’agir.
• Injection du protoxyde d’azote. On voit alors les potentiels veineux s’écarter puis disparaître en un temps plus ou moins long (± 30 s). On laisse ensuite le froid agir 240 s pour s’assurer que la lésion est transmurale et définitive
4. Réchauffement et déflation du ballon. De nouveau, on recueille les potentiels à l’ostium de la veine.
Figure 2. Isolation des veines pulmonaires en 4 étapes.
Quelles sont les éventuelles complications perprocédure ?
• L’AVC : l’ACT (activated clotting time) doit être régulièrement contrôlé pour maintenir une anticoagulation efficace.
• La tamponnade : bien que très rare, il faut toujours être attentif aux signes avant-coureurs et veiller à avoir en permanence de quoi draîner le péricarde en salle.
• La paralysie du nerf phrénique : c’est une complication relativement fréquente qui survient lors de l’isolation des veines droites (inférieures ou supérieures). Le nerf phrénique peut parfois être suffisamment proche de l’ostium des veines pour que le froid l’atteigne et le lèse. Sa perte entraîne des dyspnées d’effort très handicapantes. Pour prévenir ce risque, on stimule le nerf phrénique, à l’aide d’une sonde, via la paroi de la veine cave supérieure, tout au long de l’application du froid sur les veines droites. Ceci entraîne la contraction du diaphragme. Si l’intensité de cette contraction diminue, il faut immédiatement arrêter le froid et dégonfler le ballon. Le nerf phrénique récupérera la plupart du temps.
• Une pause sinusale prolongée : lors de l’isolation de la veine inférieure gauche, on peut dénerver les ganglions parasympathiques se trouvant à proximité, ce qui entraîne un malaise vagal. Le rythme se rétablit généralement de lui-même en quelques secondes. Mais la pause peut parfois nécessiter une stimulation du ventricule en urgence.
La technique par radiofréquence
Dans cette méthode, l’isolation n’est pas réalisée en une application, mais point par point : la sonde d’ablation par radiofréquence est déplacée autour des veines pulmonaires de façon à les encercler par une ligne de nécrose. Cette technique nécessite de connaître précisément l’emplacement de la sonde lors du tir pour que l’encerclement soit parfaitement continu. Un système de cartographie est donc indispensable (figure 3).
Figure 3. Carte anatomique de l’oreillette gauche réalisée par un système de cartographie.
Les sociétés proposant actuellement ce type de système sont la société Biosense avec le système CARTO® 3, la société St. Jude Medical avec ENSITE PRECISION™, et enfin la société Boston Scientific avec le dispositif RHYTHMIA HDX™.
Le matériel requis
Pour permettre le traitement de la FA par la technique dite par radiofréquence, il faudra disposer :
• d’une baie permettant le traitement des données recueillies par les sondes ;
• d’un cadre magnétique et son support permettant de repérer les cathéters dans l’espace. Il s’installe sous la table d’examen en regard du cœur du patient ;
• de patchs collés sur la poitrine du patient, qui servent de repères fixes pour le cadre magnétique. Il est important qu’ils soient immobiles durant l’acquisition d’une carte ;
• d’un cathéter multiélectrodes ;
• d’un cathéter d’ablation par radiofréquence ;
• d’un générateur de radiofréquence ; • d’une pompe d’irrigation du cathéter d’ablation ;
• d’un cathéter diagnostique placé dans le sinus coronaire qui servira de référence.
Déroulement de l’isolation des veines pulmonaires
1. On commence toujours par créer une carte anatomique de l’oreillette gauche la plus précise possible avec le cathéter multiélectrodes. De la qualité de cette carte dépendra la qualité de l’ablation.
2. On définit ensuite les lignes d’encerclement virtuelles (figure 4) autour des veines pulmonaires. Elles peuvent être plus ou moins complexes selon le stade de la FA (paroxystique ou permanente ; primoablation ou récidive).
3. On réalise la ligne de nécrose, point par point, en suivant les lignes prédéfinies. Grâce au lasso, on visualise la disparition des potentiels veineux.
4. On s’assure enfin de la continuité des lignes.
Figure 4. Différentes stratégies d’ablations par radiofréquence : de la simple isolation des veines (A) à la destruction des ondelettes de ré-entrée (D).
Les éventuelles complications perprocédure
• L’AVC.
• La tamponnade.
• La fistule œsophagienne : c’est une complication très grave, mortelle dans 8 cas sur 10. Pour l’éviter, on délimite le passage de l’oesophage le long de l’oreillette gauche et on adapte la force et la puissance du tir lorsqu’on en est proche. On peut également placer une sonde de température dans l’œsophage.
• La sténose des veines pulmonaires : cela arrive lorsque le tir s’effectue dans la veine. En cicatrisant, les tissus prolifèrent créant ainsi un rétrécissement de la veine pouvant être sévère. Il convient donc de faire des encerclements larges.
Conclusion
Les techniques par cryoablation et par radiofréquence pour le traitement percutané de la fibrillation atriale sont équivalentes en termes d’efficacité.
L’étude FIRE and ICE montre que « pour les patients atteints de FA paroxystique réfractaire au traitement antiarythmique, l’isolation des veines pulmonaires par cryothérapie est non inférieure à l’ablation par radiofréquence (4).
Cependant, la cryoablation ne permettra de traiter que les veines pulmonaires. En cas d’ablation complémentaire dans l’oreillette, il faudra nécessairement avoir recours à la radiofréquence.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


