Publié le 31 jan 2015Lecture 9 min
Quel suivi pour les prothèses valvulaires ?
E. BOUVIER, Service de cardiologie et chirurgie cardiaque, Hôpital Jacques Cartier, Massy
Les récentes mises à jour des recommandations internationales précisent rythme et éléments de surveillance selon le type de valve. En cas d’anomalie du bilan clinique et ETT, d’autres explorations morphologiques participent au diagnostic, en premier lieu l’ETO, mais aussi désormais les techniques d’imagerie en coupe et notamment le scanner cardiaque.
Types de prothèses valvulaires
Valves mécaniques (VM)
Désormais à double ailette en carbone, elles nécessitent les AVK efficaces à vie, sans place pour les nouveaux anticoagulants. L’INR cible dépend de facteurs de risque associant : modèle, position, antécédents thromboemboliques, ACFA, sténose mitrale, FEVG < 35 %. Contrairement à l’ESC, les recommandations ACC-AHA conseillent d’ajouter systématiquement une dose faible d’aspirine (75-100 mg) même en l’absence d’athérosclérose.
Prothèses biologiques chirurgicales (BP)
Avec ou plus rarement sans armature (stentless), animales ou plus rarement humaines (homogreffe), ne nécessitant un traitement antiagrégant ou anticoagulant que pendant 3 mois postopératoires. Actuellement, en position aortique, l’ESC recommande plutôt l’aspirine (classe IIa versus IIb) ; en position mitrale ou tricuspide, les AVK sont nécessaires.
Prothèses percutanées (TAVI)
Associant une armature métallique analogue à un stent vasculaire et des tissus biologiques, elles se rapprochent plus des BP. Les études de commercialisation réalisées avec une bithérapie antiagrégante ont incité l’ESC à recommander ce traitement pendant 6 mois malgré le faible niveau de preuve. L’évolution à long terme de ces valves, probablement proches des BP, reste à confirmer, et l’incidence des thromboses et endocardite infectieuse (EI) est encore faiblement documentée.
Mécanismes et étiologies des dysfonctions
Les dysfonctions de prothèse valvulaire (DPV) correspondent aux deux fonctions de la valve.
Dysfonction sténosante
En l’absence de toute défaillance, il existe un certain degré de sténose valvulaire car la PV ne restaure jamais un orifice aussi large que l’orifice natif, notamment en raison de l’armature.
À l’extrême, cet écart de surface entre la valve native et la PV implantée peut conduire à une inadéquation avec les besoins de débit cardiaque du patient, appelée Mismatch Patient-Prothèse (MPP), lorsque la surface calculée est < 0,85 cm2/m2 en position aortique et < 1,2 cm2/m2 en position mitrale (MPP sévère pour une surface aortique < 0,65 cm2/m2 et mitrale < 0,9 cm2/m2). Cette situation doit être prévenue systématiquement en préopératoire par le calcul de la surface indexée d’après les mesures constructrices de l’orifice et la surface corporelle du patient, notamment quand la taille de l’anneau valvulaire est modeste.
De façon pathologique, le gradient peut s’élever secondairement en raison :
- de la perte de mobilité des éléments mobiles et/ou une obstruction par une thrombose ou des végétations d’EI ;
- la dégénérescence d’une BP, plus ou moins calcifiée ;
- la présence d’un obstacle sous/supravalvulaire qui peut parfois altérer le jeu valvulaire : le pannus ;
- un hyperdébit valvulaire : hyperdébit cardiaque (anémie, fièvre, hyperthyroïdie, fistule, cirrhose) ou fuite prothétique majorant le débit antérograde ; l’index de perméabilité et la surface fonctionnelle sont alors normaux car l’ITV sous-aortique est augmenté.
L’élévation du gradient mesuré sera rarement imputable à un gradient localisé dans le jet central d’une VM à double ailette ou à un phénomène de restitution de pression dans une petite aorte, tous deux sans valeur pathologique.
Dysfonction fuyante
De façon analogue à l’obstruction, des fuites physiologiques peuvent exister dès le postopératoire immédiat et ne représenter aucun risque significatif. Il s’agit notamment des microfuites intraprothétiques dites de lavage d’une VM. Les fuites paraprothétiques minimes (grade 1) sur TAVI ne semblent pas associées à un pronostic péjoratif.
De façon pathologique, une fuite peut apparaître ou se majorer secondairement :
- fuite intraprothétique : par dégénérescence, thrombose ou EI ;
- fuite paraprothétique : par désinsertion sur EI ou sur des tissus fragiles aseptiques.
Notamment dans ce dernier cas, aux symptômes cardiaques liés à la DPV peuvent s’ajouter les signes cliniques et biologiques d’une anémie hémolytique (asthénie, pâleur/ictère, hémoglobinurie), documentée par les dosages d’hémoglobine, schizocytes, LDH et haptoglobine.
Dans les thromboses, dégénérescences et EI, les deux types de dysfonctions peuvent s’associer.
Stratégie de surveillance
Conformément aux recommandations ESC, le suivi systématique des PV après la sortie de l’hôpital comporte :
Un bilan initial, 6 à 12 semaines après la chirurgie : examen clinique, radiographie de thorax, ECG, bilan biologique et échographie cardiaque transthoracique (ETT).
Cette échographie initiale servira de véritable carte d’identité de la PV, permettant de préciser ses caractéristiques basales à distance des facteurs perturbants périopératoires (échogénicité dégradée, anémie, tachycardie, voire fièvre). Gradients et surface fonctionnelle serviront ainsi de référence pour le suivi. C’est surtout à ce stade que le MPP peut être évoqué.
Une surveillance cardiologique à vie : examen clinique annuel systématique et plus souvent en cas de symptomatologie cardiaque évolutive. L’ETT systématique annuelle se justifie après la 5e année chez les porteurs de BP, éventuellement plus tôt chez les patients jeunes. Dans les autres cas, elle est justifiée en cas de nouveau symptôme ou suspicion de complication. Ses mesures seront comparées aux valeurs de l’ETT de référence. L’ETO sera envisagée si l’ETT est de qualité insuffisante et dans tous les cas de suspicion de DPV, notamment d’EI. Radiocinéma de valve et scanner cardiaque sont proposés en 3e ligne.
Les recommandations de la HAS 2012 diffèrent légèrement, en permettant une ETT systématique : tous les 3 ans chez les porteurs de VM aortique asymptomatique, tous les 3 mois pendant la grossesse, tous les ans chez les patients ayant une instabilité de l’anticoagulation, tous les 2 à 3 ans pour les porteurs d’homogreffe. Pour mémoire, les recommandations nord-américaines diffèrent légèrement en proposant l’ETT annuelle systématique chez les porteurs de BP seulement à partir de la dixième année (classe IIa, niveau de preuve C).
Techniques d’exploration
Échographie transthoracique
L’imagerie 2D et TM étudie la morphologie de la PV, recherche des calcifications de BP ou des images tissulaires anormales de thrombus ou végétation, une réduction de cinétique des éléments mobiles en position ouverte ou fermée, voire une bascule de PV. En pratique, la rentabilité diagnostique de cette étape dépend beaucoup de l’échogénicité, de la position et de la nature de la PV, les VM étant sources d’artefacts intérieurs et postérieurs.
La contribution du Doppler est majeur et beaucoup plus constante, avec ses différentes modalités :
- Doppler couleur : flux antérograde, flux rétrograde, fuites pathologiques intra- ou paraprothétiques (présence, localisation, sévérité) ;
- Doppler pulsé + continu, à confronter aux valeurs de base plutôt qu’aux valeurs de références publiées :
* vitesse maximale (aortique < 3 m/s, mitrale < 1,9 m/s),
* gradients moyen et maximal (moyen aortique < 20 mmHg et moyen mitral < 5 mmHg),
* PHT mitrale (N < 130 ms),
* surface fonctionnelle par équation de continuité (aortique > 1,2 cm2, mitrale > 2,0 cm2) qui peut être indexée à la surface corporelle, à utiliser avec circonspection en raison des nombreux pièges sur l’estimation de la chambre de chasse,
* index de perméabilité en position aortique (N > 0,30), nettement plus reproductible,
* temps d’accélération en position aortique (N < 80 ms),
*quantification d’une fuite notamment par la fraction régurgitée ou le reflux télédiastolique dans la crosse pour une IA, tant la mesure du jet à son origine est souvent difficile liée à une géométrie complexe et aux artefacts sur le matériel prothétique.
En pratique, un gradient moyen supérieur à 15-20 mmHg en position aortique ou 5-10 mmHg en position mitrale est suspect de DPV sténosante et incite à mesurer l’ensemble des indices.
Le rendement de l’ETT seule sera meilleur dans le diagnostic de MPP, avec une obstruction dès l’examen initial et une surface fonctionnelle indexée basse, et dans le diagnostic de dégénérescence de BP, avec des cusps épaissies et calcifiées de mobilité réduite, pouvant prolaber, avec obstruction et/ou fuite pathologique intraprothétique. Dans les autres causes de DPV (thrombose, pannus, désinsertion, EI), son rendement est plus modeste. Par exemple, une fuite paraprothétique sur VM mitrale peut parfois se traduire uniquement par une élévation de gradient, le jet étant masqué en ETT par l’ombre de la prothèse.
Dans tous les cas, l’ETT sera complétée pour évaluer la tolérance de la DFV.
Échographie transœsophagienne
Devant toute suspicion de dysfonction valvulaire, si l’ETT n’est pas concluante ou systématiquement si l’EI est évoquée, l’ETO offre un point de vue complémentaire, à haute résolution, avec une échogénicité plus constante et désormais la possibilité d’une imagerie 3D de qualité, compensant largement son caractère semi-invasif. La qualité technique est meilleure pour les prothèses mitrales, notamment sur leur versant auriculaire, en raison de l’anisotropie des ultrasons et des artéfacts majeurs à la traversée des matériaux non biologiques. Les indices Doppler recueillis sont analogues à l’ETT.
Sa rentabilité diagnostique est particulièrement importante pour les thromboses de prothèse, les désinsertions et EI (végétations et/ou abcès), voire pour les dégénérescences de BP en cas de doute après l’ETT. Les lésions touchant le versant ventriculaire des prothèses mitrales, notamment mécaniques, seront plus difficiles à objectiver, malgré l’apport éventuel de l’inconstante voie transgastrique. Le diagnostic de pannus reste difficile, notamment en position aortique.
Radiocinéma de valve
Très accessible, il recherche une anomalie de cinétique des ailettes de VM uniquement, sans en préciser l’étiologie, voire une bascule de l’armature qui traduirait une désinsertion très étendue.
IRM cardiaque
Elle est particulièrement inadaptée au métal ou au carbone, qui peuvent en outre générer des artéfacts importants à leur voisinage. Pour les BP, elle offre par contre une imagerie à haute définition temporelle et spatiale, quasi isotrope, utilisable quels que soient la position de la PV et le versant de la lésion, non invasive, non irradiante, sous réserve de l’absence de pacemaker ou DAI. Les séquences de flux en contraste de phase apportent des informations hémodynamiques proches du Doppler. En pratique, le rendement diagnostique après ETO reste modeste hormis pour la quantification des fuites paraprothétiques aortiques complexes.
Tomodensitométrie cardiaque
D’introduction plus récente, la tomodensitométrie (TDM) cardiaque (ou scanner cardiaque) est une technique d’imagerie tridimensionnelle à haute résolution spatiale basée sur les rayons X et l’injection d’un produit de contraste iodé, particulièrement adaptée aux structures non biologiques comme le carbone ou le métal qui offrent un haut contraste naturel avec les tissus biologiques, et prometteuse dans les DPV. Le rehaussement plus homogène des cavités gauches offre une meilleure qualité sur les PV mitrale ou aortique que sur les valves droites, les deux versants des PV étant également analysables. Cet outil ubiquitaire de moins en moins irradiant nécessite une fréquence cardiaque stable et sa résolution temporelle modeste limite l’étude des petites structures très mobiles comme les végétations ou thrombi de faibles dimensions. Les informations hémodynamiques se limitent au calcul des débits, voire des fractions régurgitées.
En pratique, outre un radiocinéma de valve en 3D, la TDM paraît très contributive dans le diagnostic de pannus tissulaire en continuité avec le myocarde adjacent, notamment en position aortique, pour le diagnostic de thrombose en particulier sur TAVI, pour les dégénérescences de BP, notamment dans la perspective d’un TAVI valve-in-valve, pour la caractérisation, voire la surveillance précise des abcès paraprothétiques, et à un moindre degré pour les désinsertions, en particulier dans la perspective d’une fermeture percutanée par plug.
Tomographie par émission de positrons + scanner (TEP-TDM = PET-CT)
Récemment plusieurs études ont démontré l’intérêt de cette imagerie hybride isotopique pour le diagnostic d’EI sur PV, en association avec les critères de Duke, en réduisant le nombre de cas incertains, renforçant nettement la sensibilité diagnostique au prix d’une discrète baisse de spécificité.
En pratique
Au total, le suivi d’une PV repose encore essentiellement sur le suivi clinique et l’ETT selon un rythme bien défini, hormis le cas spécifique des prothèses TAVI qui reste à préciser.
En cas d’anomalie, le recours large à l’ETO suffit le plus souvent à compléter le diagnostic.
En troisième ligne, la TDM paraît particulièrement complémentaire avec l’imagerie échographique, et prometteuse en particulier pour le diagnostic différentiel du pannus.
Le recours au TEP-TDM devrait fiabiliser significativement le diagnostic d’EI sur prothèse.
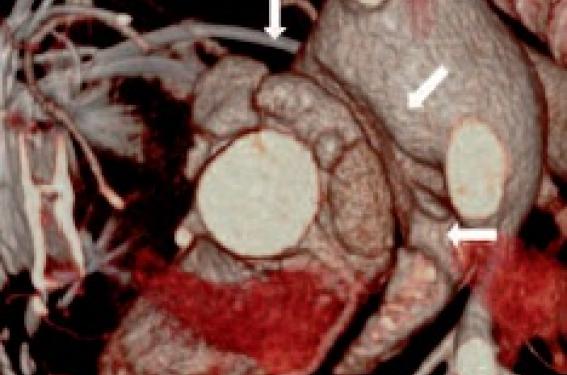
Aspect typique de pannus en scanner, sur le versant ventriculaire d’une prothèse mécanique à ailettes en position aortique, masquant l’armature sur la vue 3D (à gauche) et visible sous la forme d’hypodensités statiques sous les ailettes en coupe longitudinale (à droite).
Dégénérescence calcifiante de bioprothèse aortique en scanner.
Thrombose obstructive de prothèse TAVI CoreValve® en scanner (diastole à G, systole à D).
Abcès paraprothétique détergé d’une valve mécanique aortique en scanner (vue 2D à gauche, 3D à droite précisant l’extension exacte et les rapports anatomiques).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité






