Thérapeutique
Publié le 25 jan 2011Lecture 10 min
AHA - Cardiologie High tech
T. Le TOURNEAU, Hôtel Dieu, CHU de Nantes
Le congrès de l’AHA a été déserté cette année par les principaux constructeurs d’échocardiographes, seuls Esaote et Aloka étaient présents avec des machines de bonne qualité d’entrée et de milieu de gamme. Il n’y a donc pas eu de présentation d’innovation technologique majeure. Tout au plus peut-on citer le logiciel de cartographie et de vectorisation de flux développé depuis quelque temps sur station de travail par Aloka, permettant une étude des vecteurs et des vortex de flux au sein du ventricule gauche à partir de l’enregistrement des flux en Doppler couleur.
Même si la validité de l’analyse des flux dans toutes les directions est sujette à caution, en particulier pour la vectorisation des flux qui ne sont pas dans l’axe du tir Doppler, quelques travaux présentés au congrès ont utilisé ce type de logiciel. Un travail réalisé au Japon suggère ainsi que le gradient de pression télésystolique le long de la ligne de flux reliant l’apex à la chambre de chasse est bien corrélé aux paramètres de relaxation tels que la –dP/dt et la constante de temps Tau. Damien Coisne de Poitiers a validé in vitro l’analyse des flux intracavitaires basée cette fois-ci sur l’emploi de produit de contraste. Un logiciel d’évaluation des vecteurs de flux, basé également sur l’emploi d’agent de contraste, a été développé par Siemens (Omega flow). L’étude des flux intraventriculaires gauches suggère que les patients présentant un thrombus apical ont un déplacement du vortex de flux de l’apex vers le centre de la cavité ventriculaire gauche. Après la mise à disposition des outils d’étude du myocarde par « speckle tracking », la prochaine évolution technologique des échocardiographes pourrait peut-être concerner l’étude des flux intracavitaires.
Resynchronisation atrioventriculaire
Après les résultats des études CARE-HF et PROSPECT ayant démontré le manque de fiabilité des critères échocardiographiques pour la sélection des patients pouvant bénéficier d’une resynchronisation, les résultats de l’étude SMART-AV (The SmartDelay Determined AV Optimization : A Comparison to Other AV Delay Methods Used in Cardiac Resynchronization Therapy) étaient très attendus.
L’étude SMART-AV avait pour objectif de comparer trois modes de réglage du délai atrioventriculaire après resynchronisation ventriculaire et d’étudier son impact sur le remodelage ventriculaire (volume télésystolique) 6 mois après implantation. Les critères secondaires comprenaient la classe NYHA, un score de qualité de vie, le test de marche de 6 min, le volume télédiastolique et la fraction d’éjection (FE) du ventricule gauche (VG). Les patients inclus devaient être en insuffisance cardiaque classe III ou IV de la NYHA malgré un traitement médical optimal, avoir une FEVG ≤ 35 % et des QRS ≥ 120 ms, et relever d’une resynchronisation cardiaque et de l’implantation d’un défibrillateur.
L’étude a randomisé 980 patients américains (66 ± 11 ans) en 3 groupes équivalents. Le délai AV était soit fixé par le constructeur à 120 ms (n = 325), soit optimisé par échocardiographie (n = 323) ou déterminé par le système de réglage automatique SmartDelay (n = 332). La FEVG était en moyenne à 25 % à l’inclusion, la durée des QRS à 153 ms et 75 % des patients avaient un bloc de branche gauche. Le volume télésystolique du ventricule gauche était d’environ 120 ml soit 60 ml/m² à l’inclusion. Les patients ont été évalués 3 et 6 mois après implantation. Le volume télésystolique a diminué de 120 ml à 97 ml (48 ml/m²) sans différence significative entre les 3 groupes (figure 1).
Figure 1. Absence d’effet significatif sur le remodelage VG (variation du volume télésystolique du ventricule gauche) après resynchronisation cardiaque entre les différents modes de réglage du délai atrioventriculaire (délai automatique, délai guidé par échocardiographie, délai fixe à 120 ms).
Il n’a pas été mis en évidence de différence concernant la classe NYHA, la qualité de vie, le test de marche ou encore les volumes télédiastolique et la FEVG entre les 3 groupes, ce qui suggère qu’il n’y a pas d’intérêt à régler de façon systématique le délai atrioventriculaire sur les données de l’échocardiographie après resynchronisation. Ce réglage échoguidé pourrait cependant avoir une place en pratique chez les patients qui restent symptomatiques malgré le traitement médical et la resynchronisation.(1)
Fermeture d’un FOP après AVC ou AIT
Le risque de récidive d’AVC ou AIT cryptogénique est clairement augmenté en cas d’anévrisme du septum interauriculaire (ASIA) associé à un foramen ovale perméable (FOP). La migration à travers le FOP d’un petit thrombus d’origine veineux (embole paradoxal) est l’étiologie possible des AVC ou AIT survenant dans ce contexte. Malgré l’absence de preuve formelle, la fermeture du FOP est une procédure de plus en plus répandue chez ces patients, en particulier devant un orifice de grande taille.
L’étude CLOSURE 1(2) a été mise en place pour tenter de déterminer l’intérêt d’une telle procédure en comparaison au traitement médical optimal. Les résultats du suivi à 2 ans ont été présentés lors du congrès de l’AHA. L’étude a enrôlé 910 patients ayant présenté un AVC ou un AIT avec mise en évidence en ETO d’un FOP isolé ou associé à un ASIA, qui ont été randomisés en deux groupes, fermeture du FOP par le système STARFlex® associé au traitement médical optimal (clopidogrel 75 mg/j pendant 6 mois et aspirine 325 mg/j pendant 2 ans) ou traitement médical optimal seul (aspirine 325 mg/j ou warfarine). Les critères de jugement étaient la récidive d’AVC ou AIT à 2 ans, la mortalité toutes causes à 30 jours, et la mortalité d’origine neurologique du 31e jour à 2 ans.
L’étude n’a pas mis en évidence de différence de taux d’événements entre les deux groupes ; la fermeture percutanée du FOP a entraîné dans 3 % des cas une complication vasculaire majeure. La mortalité d’origine neurologique du 31e jour à 2 ans a été de 5,9 % après fermeture percutanée et de 7,7 % sous traitement médical seul (p = 0,30). Une récidive d’AVC a été notée dans 3,1 % et 3,4 % des cas respectivement (p = 0,77) et une récidive d’AIT dans 3,3 % et 4,6 % des cas (p = 0,39).
La conclusion de l’étude est qu’il n’y a pas d’avantage actuellement à opter pour une fermeture percutanée systématique du FOP chez les patients ayant présenté un AIT/AVC cryptogénique. L’étude française CLOSE incluant uniquement des patients avec FOP + ASIA (donc à plus haut risque de récidive) permettra de préciser l’attitude thérapeutique chez ce sous-groupe de patients.
Intérêt de l’ETO 3D dans les procédures d’implantation MitraClip®
Il existe un regain d’intérêt pour les maladies valvulaires, probablement grâce au renouveau des solutions thérapeutiques par cathétérisme interventionnel et chirurgie mini-invasive. Parmi de nombreuses sessions, Willian Zoghbi a rappelé la place prépondérante de l’échocardiographie dans la prise en charge des pathologies valvulaires, tandis que les techniques de mesure de pression par cathétérisme ne sont plus utilisées que dans certaines situations difficiles. L’échocardiographie est clairement l’outil clé pour le diagnostic, l’évaluation de la sévérité de la valvulopathie et de son retentissement ; elle oriente la décision thérapeutique, guide les gestes interventionnels percutanés et chirurgicaux, en évalue le résultat et permet la surveillance des patients au long cours.
R. Siegel (Cedars-Sinai Medical Center, Los Angeles) a longuement exposé son expérience de l’ETO 3D pour la mise en place du dispositif MitraClip® lors d’une passionnante session portant sur la place de l’imagerie dans les procédures valvulaires percutanées. Ce dispositif, destiné au traitement percutané de l’insuffisance mitrale organique ou fonctionnelle, mime la procédure d’Alfieri de suture bord à bord des deux valves mitrales. Il a été implanté chez plus de 2 000 patients à travers le monde, essentiellement chez des sujets à haut risque. De nombreuses données sont à présent disponibles dans les registres ou études ACCESS et EVEREST. La mise en place du MitraClip® apparaît cependant complexe et pourrait bénéficier de l’apport systématique de l’ETO 3D. C’est en tout cas l’avis de R. Siegel qui a présenté les différentes étapes de la procédure échoguidée par l’ETO 3D.
R. Siegel distingue ainsi 7 étapes au cours de la procédure d’implantation du MitraClip® au cours desquelles l’ETO 3D pourrait avoir un rôle important :
• lors d’un cathétérisme transeptal guidé par l’ETO 3D en mode multiplan et en mode de rendu volumique ;
• lors de l’ntroduction du cathéter dans l’oreillette gauche et son positionnement par rapport à la valve mitrale ;
• pendant l’insertion du système de délivrance du dispositif dans l’oreillette gauche ;
• au moment de l’ouverture du clip mitral dans l’oreillette gauche juste au-dessus de la valve, pour s’assurer de son orientation perpendiculairement à la ligne de coaptation mitrale en regard de la portion moyenne de la valve mitrale (A2P2) ;
• pendant l’avancée du dispositif dans la cavité ventriculaire gauche juste en dessous des valves en corrigeant son positionnement par rapport à la ligne de coaptation en s’aidant des voies transœsophagienne et transgastrique ;
• lors de l’ancrage du dispositif en s’aidant en particulier de l’incidence grand axe du ventricule gauche. L’ETO 3D permet ainsi de vérifier le positionnement du dispositif, d’évaluer la surface des 2 orifices mitraux, la réduction de la fuite mitrale avant de fixer définitivement le clip ou de le repositionner, voire d’en ajouter un second. Le gradient transvalvulaire mitral sera également évalué. L’ETO 3D en mode Doppler couleur permet de déterminer l’importance et la localisation de la fuite résiduelle.
• enfin, la dernière étape concerne l’évaluation du résultat après libération complète du clip de son support de délivrance.
L’ETO 3D a ainsi une place de choix dans ce type de procédure, lors de l’évaluation préprocédurale pour la sélection du patient en fonction de la morphologie mitrale, lors de la procédure elle-même, et pour apprécier le résultat final en fin de procédure. R. Siegel conclut cette présentation en affirmant le caractère indispensable de l’ETO 3D au cours de cette procédure complexe et son apport incontestable par rapport à l’ETO 2D.
Oreillette gauche
Plusieurs travaux se sont penchés sur l’intérêt pronostique de la mesure du volume de l’oreillette gauche (OG). Dans la Dallas Heart Study, le volume de l’OG a été déterminé par la méthode surface-longueur biplan chez 1 886 patients en excluant les veines pulmonaires et l’auricule gauche. Les limites de la valeur normale du volume de l’OG ont été définies entre le 2,5e et le 97,5e percentile dans une population sans pathologie cardiaque. Selon ce critère l’OG apparaît dilatée lorsqu’elle dépasse 50 ml/m² chez l’homme et 46 ml/m² chez la femme.
La pression artérielle systolique, un antécédent d’hypertension artérielle et le taux de peptides natriurétiques sont associés à une augmentation de volume indexé de l’OG. La forme apicale de la cardiopathie hypertrophique est considérée comme ayant un pronostic en général plus favorable que d’autres formes de CMH. Dans une large série de 454 patients présentant une CMH apicale, la dilatation de l’OG était un facteur prédictif de la mortalité cardiovasculaire et des événements lors du suivi. De même, dans l’insuffisance cardiaque à fraction d’éjection préservée, un volume indexé d’OG ≥ 43 ml/m² était prédictif de la survenue d’un événement cardiaque lors du suivi dans une cohorte de 97 patients.
Déformation myocardique
L’étude des déformations myocardiques par speckle tracking (2D strain) présente de nombreuses applications potentielles en pratique clinique qui restent cependant à définir par des études prospectives. La déformation myocardique longitudinale globale du ventricule gauche (GLS) est altérée dans la CMH en comparaison avec des sujets témoins. La fibrose myocardique de type nodulaire, mise en évidence par le rehaussement tardif au gadolinium en IRM, est fréquente au cours de la CMH, témoignant de l’altération structurelle du myocarde.
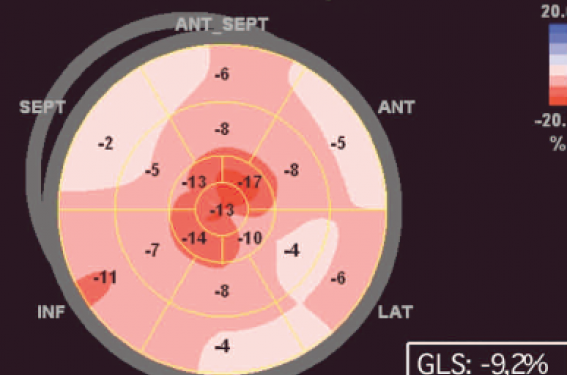
Dans une étude ayant inclus 47 patients, le GLS était significativement altéré chez les 35 patients présentant un rehaussement tardif au gadolinium (-11,8 ± 2,9 vs -15 ± 1,7 % ; p = 0,002). De plus, le GLS s’est avéré être le principal facteur prédictif du pourcentage de rehaussement tardif (figure 2) et donc de fibrose myocardique chez ces patients porteurs de CMH.
Figure 2. Altération de la déformation myocardique globale du ventricule gauche (GLS : -9,2 %) chez un patient présentant une CMH avec fibrose marquée (20 % de la masse myocardique) en IRM.
L’obésité et le diabète sont associés à une augmentation du risque d’insuffisance cardiaque par des mécanismes différents. Dans une large étude prospective, 337 patients présentant un diabète de type 2 ont été classés en 3 groupes (mince, surpoids, obèse) et comparés avec 316 patients sains appariés sur l’âge, le sexe et l’indice de masse corporelle (IMC). Malgré une FE identique entre les groupes, le GLS s’altère progressivement avec l’augmentation de l’IMC et cette altération est plus marquée chez les patients diabétiques (figure 3), témoignant de l’altération progressive de la fonction myocardique du ventricule gauche avec l’augmentation de poids et le diabète. Le GLS est également altéré dans l’insuffisance cardiaque à FE préservée comparativement à des sujets témoins (-14,4 ± 3,6 vs -21,2 ± 3,2 % ; p < 0,0001). La réflectivité du myocarde est augmentée (fibrose myocardique) au cours de l’insuffisance cardiaque à FE préservée et est bien corrélée au GLS.
Figure 3. Altération de la déformation myocardique longitudinale globale du ventricule gauche (GLS) en fonction de la surcharge pondérale chez des sujets diabétiques ou non diabétiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :