Publié le 03 mai 2011Lecture 14 min
Quel bilan faire après un arrêt cardiaque ressuscité ?
C. KOUAKAM, CHU Lille
La mort subite représente environ 10 % de la mortalité totale et près de la moitié des décès de cause cardiaque. Elle est souvent la première (et malheureusement souvent la dernière) manifestation de problèmes cardiaques insoupçonnés. L’immense majorité des cas de mort subite résulte d’un collapsus hémodynamique survenu au décours d’un trouble du rythme ventriculaire, le plus souvent secondaire à une cardiopathie structurelle. Les étiologies spécifiques varient selon la population étudiée et l’âge des patients.
La mort subite sur cœur strictement normal est une entité rare ; la majorité survient en réalité sur des cœurs pathologiques insoupçonnés, pour lesquelles les outils diagnostiques modernes permettent d’identifier l’anomalie de structure ou de fonction sous-jacente. Autrefois, les étiologies de la plupart de ces morts subites étaient inconnues et étaient considérées comme «idiopathiques». Plusieurs découvertes majeures, dans le domaine de la génétique notamment, associées aux progrès de l’imagerie cardiovasculaire ont permis d’identifier la cause de la mort subite chez la plupart de ces patients. La mort subite peut également être secondaire à une pathologie non cardiaque (traumatisme, hypoxie, embolie pulmonaire massive, épilepsie, etc.) qu’il faut savoir envisager ; mais ces dernières étant plus rares, la mort subite d’origine cardiaque est souvent confondue avec la mort subite d’origine rythmique dont nous traiterons principalement.
Épidémiologie de la mort subite de l'adulte
L’épidémiologie de la mort subite reste mal connue car, en l’absence d’autopsie, la cause du décès est rarement établie avec certitude. De plus, sa définition même est loin d’être consensuelle, même si la plupart des auteurs s’accordent pour dire qu’il s’agit d’un décès inattendu survenant dans l’heure qui suit l’apparition des premiers symptômes en l’absence de secours immédiat(1-4).
Dans la majorité des pays industrialisés, la mort subite de l’adulte est un problème majeur de santé publique dont la solution passe essentiellement par la prévention des maladies cardiovasculaires et l’identification des groupes à risque dont la sélection réduit en valeur absolue le nombre de victimes (figure 1).
Figure 1. Incidence de la mort subite cardiaque aux Etats-Unis. Nombre absolu d’évènements et pourcentage des morts subites dans la population générale et les sous-groupes à risque. D’après Myerburg RJ et coll.2.
En effet, malgré les progrès de la prise en charge préhospitalière et les avancées des techniques de réanimation, à peine 5 % des victimes d’un arrêt cardiaque survivront, sauf dans certaines communautés « à la pointe »(5) ; on parle alors de mort subite ressuscitée. À court terme, la prise en charge de ces survivants nécessite que soit établie la cause de leur mort subite pour guider l’implantation d’un défibrillateur automatique, seule arme fiable et efficace pour prévenir les récidives. À long terme, l’optimisation de leur prise en charge individuelle et au besoin familiale dépendra en grande partie du diagnostic étiologique.
La mort subite de l’adulte affecterait chaque année en France environ 30 000 à 50 000 personnes(6) et de 300 000 à 400 000 aux Etats-Unis(4,5). Elle peut survenir à tout âge, mais il existe un pic de fréquence entre 45 et 75 ans. Elle survient à domicile dans 85 % des cas et durant le sommeil dans 35 %. Dans près de la moitié des cas, elle concerne des sujets de la population générale sans pathologie cardiaque connue. Les patients qui ont survécu à un premier épisode sont exposés à un risque important de récidive et 40 % décèdent dans les deux années suivantes(7).
Étiologie et pathophysiologie de la mort subite cardiaque
Sur le plan clinique et étiologique, les troubles du rythme cardiaque sont responsables de la grande majorité des morts subites, la fibrillation ventriculaire (FV) représentant 80 % des arythmies documentées(8). La FV fait habituellement suite à une tachycardie ventriculaire (TV) qui s’accélère et dégénère.
La maladie coronarienne représente la principale cause de mort subite cardiaque, mais d’autres étiologies sont rencontrées, notamment les cardiomyopathies et les maladies génétiques héréditaires(1-6).
Les causes de la mort subite d’origine rythmique
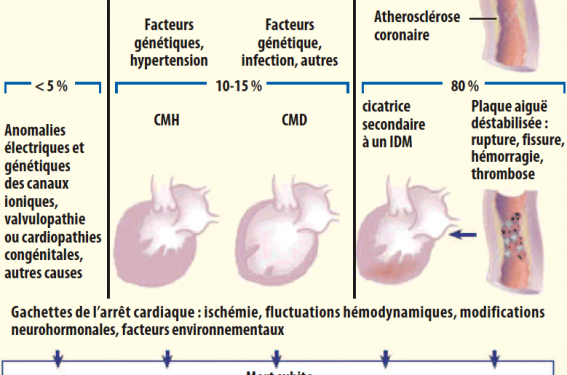
L’atteinte coronaire représente environ 80 % des cas de mort subites d’origine rythmique, soit par FV au cours d’une ischémie aiguë, soit dans l’évolution de la cardiopathie consécutive à une atteinte coronaire chronique avec ou sans séquelles d’infarctus(1,6-8). Quinze pour cent des morts subites surviennent sur une cardiomyopathie dilatée non ischémique, hypertrophique ou valvulaire, et les autres causes étant retrouvées chez environ 5 % des patients (figure 2)(8).
Figure 2. Pathophysiologie et épidémiologie de la mort subite d’origine cardiaque.
Il existe de nombreuses étiologies responsables de mort subite rythmique (tableau). Leur répartition varie en fonction de l’âge, du sexe, des antécédents familiaux (figure 3)(9). Schématiquement, on considère qu’après 40 ans dominent les conséquences de l’athérosclérose coronaire. Chez les sujets plus jeunes, la responsabilité est partagée entre certaines cardiomyopathies telles que la cardiomyopathie hypertrophique et la dysplasie arythmogène ventriculaire droite, et les troubles rythmiques génétiques.
Figure 3. Répartition des causes de mort subite rythmique. D’après Huikuri HV et coll.8 pour la partie haute (toutes causes); et Krahn AD et coll.9 pour la partie basse (autres causes).
Mécanismes de la mort subite d’origine rythmique
Les facteurs de risque de la mort subite se confondent avec ceux de l’athérosclérose coronaire. S’y ajoutent d’autres marqueurs purement rythmiques et le risque familial indépendant.
Sur le plan physiopathologique, la mort subite rythmique est un accident plurifactoriel où des modifications transitoires favorisent l’action d’un facteur déclenchant instantané (gâchette) sur un substrat arythmogène anatomique (figure 4).
Figure 4. Mécanismes de la mort subite rythmique expliqué par le concept du « triangle de l’arythmogénèse ». DEM: dissociation électromécanique; TV/FV: tachycardie/fibrillation ventriculaire.
Démarche diagnostique devant une mort subite de l'adulte
Éliminer une cause aiguë réversible ou une cause curable
Après un épisode de mort subite d’origine rythmique, survenue en l’absence de cause aiguë réversible (trouble métabolique, IDM de moins de 48 heures, etc.), la prévention secondaire repose exclusivement sur le défibrillateur automatique implantable (DAI) qui a clairement démontré une réduction de la mortalité rythmique et globale chez des patients ressuscités d’une mort subite (indication de classe I, niveau de preuve A). Le défibrillateur est contre-indiqué lorsque la FV ou la TV responsable de la mort subite est curable (indication de classe III)(10-12).
La phase aiguë de l’infarctus du myocarde est la cause aiguë réversible la plus fréquemment rencontrée bien entendu. Connue de longue date grâce aux résultats de séries d’autopsies, cette notion a été remise à l’ordre du jour par les travaux de Spaulding et coll. qui, en réalisant des coronarographies juste après la ressuscitation, ont trouvé près de 50 % d’occlusion coronaire aiguë(13). En dehors de l’infarctus, le spasme coronaire peut être une cause de mort subite susceptible de bénéficier d’un traitement.
Certaines myocardiopathies peuvent être réversibles comme les myocardites aiguës(9), le syndrome de Takotsubo(14), ou certaines atteintes myocardiques aiguës toxiques… Le risque de mort subite peut alors disparaître avec la guérison de ces affections, sauf si elles laissent des cicatrices qui peuvent alors constituer un substrat arythmogène.
La FV peut très rarement être la conséquence d’une TV rapide d’étiologie curable sur cœur sain (TV infundibulaires ou fasciculaires)(12).
Le traitement curatif de ces troubles du rythme par ablation par radiofréquence peut rendre aux patients un pronostic de sujet sain en l’absence d’anomalies structurales du myocarde.
Les FV induites par une fibrillation auriculaire, conduisant de façon très rapide dans le ventricule en raison de la présence d’une voie accessoire très perméable en antérograde, sont plus fréquentes (figure 5). Là encore, l’ablation endocavitaire de la voie accessoire permet de traiter définitivement la cause de la FV, et ainsi d’éviter l’implantation d’un DAI.
Figure 5. Mort subite sur faisceau de Kent malin. Noter l’aspect ECG pathognomonique en accordéon en tachycardie (A) qui doit faire évoquer le diagnostic de pré-excitation.
• Les troubles ioniques majeurs peuvent aussi être une cause curable de troubles de la conduction ou du rythme ventriculaire graves.
Toutefois, leur diagnostic au décours de la réanimation initiale n’en est pas toujours aisé. Il en est de même des effets pro-arythmiques des médicaments, même à dose thérapeutique, par exemple dans le cadre du QT long acquis(15). Les intoxications médicamenteuses et/ou la consommation de drogues illicites arythmogènes (amphétamines, cocaïne, colles, etc.) doivent être recherchés le plus précocement possible au cours de la prise en charge et en pratique en milieu de réanimation bien avant la prise en charge par les rythmologues.
• De manière plus anecdotique, il faut citer le commotio cordis qui fait référence aux morts subites chez le sportif jeune au décours d’un traumatisme précordial en période vulnérable(16), ou les électrocutions. Enfin, chez les patients porteurs de pacemaker, en particulier les stimulodépendants, un défaut de stimulation ou un déclenchement de FV peut induire une mort subite par stimulation ventriculaire en période vulnérable en cas de défaut d’écoute(17). Chez les patients porteur d’un DAI, un choc inapproprié en cas de surdétection peut induire un trouble du rythme potentiellement létal(18). Le contrôle des pacemakers et DAI est donc indispensable après une mort subite chez les patients qui en sont porteurs.
Savoir reconnaître les atteintes cardiaques d’origine génétique qui nécessitent une prise en charge spécifique individuelle et familiale
Certaines causes de mort subite cardiaque nécessitent d’être correctement identifiées, soit parce qu’elles ont des éléments de prise en charge spécifiques, soit parce que ce sont des pathologies rythmiques héréditaires qui doivent être recherchées chez les membres de la famille du patient index. Comme leur nom l’indique, ces affections sont transmissibles. Les descendants peuvent être porteurs de la mutation, de même que les parents s’il ne s’agit pas d’une mutation de novo. Ces pathologies sont divisées en groupe avec atteinte cardiaque visible (cardiomyopathies dilatées, cardiomyopathies hypertrophiques, dysplasie ventriculaire droite arythmogène), et groupe avec cœur apparemment sain (par anomalie des courants électriques cardiaques).
Dans ces pathologies, les facteurs de risque de mort subite plus spécifiques sont des antécédents de mort subite familiaux, de syncopes, palpitations et trouble du rythme. Souvent la mort subite est le premier et dernier symptôme chez des patients jusqu’alors asymptomatiques. Le dépistage des apparentés atteints est fondamental, et fait de plus en plus appel à la génétique(19-21).
Avec 1/500 sujet atteint dans la population générale, la cardiomyopathie hypertrophique est la plus fréquente des maladies cardiovasculaires héréditaires et la cause la plus fréquente de mort subite chez le sujet jeune et le sportif de haut niveau. La mort subite est la 1re manifestation clinique de la maladie dans plus de 50 % des cas, d’où l’importance du dépistage familial(21).
La dysplasie ventriculaire droite arythmogène (DVDA) présente quelques particularités par la difficulté du diagnostic qui est basé sur un faisceau d’arguments(22), la survenue de troubles du rythme ventriculaire à l’effort et l’effet protecteur des b-bloquants. La DVDA est maintenant identifiée comme une pathologie héréditaire des desmosomes, qui doit donc être recherchée chez les membres de la famille(21,22).
Les syndromes du QT long congénital, du QT court, de Brugada et la TV polymorphe catécholergique sont des maladies héréditaires plus rares dont l’épidémiologie est mal connue. Le plus fréquent est le syndrome du QT long congénital dont 12 phénotypes sont actuellement décrits en fonction du type de canal ionique atteint (figure 6). Les types 1 et 2 touchent des canaux potassiques et représentent la majorité des cas. Il est dans tous les cas fondamental de rechercher la prise concomitante de traitements qui allongent la repolarisation(15). Si l’implantation d’un DAI est la règle en prévention secondaire, il faut cependant noter que le type 1 est très sensible aux b-bloquants et que leur arrêt peut suffire à précipiter la mort subite(23).
Il en est de même pour les TV polymorphes catécholergiques(24).
Figure 6. Différents phénotypes électrocardiographiques du syndrome du QT long congénital.
La prise en charge en prévention secondaire de la mort subite passe par l’implantation d’un DAI, y compris pour le syndrome de repolarisation précoce récemment décrit par Haïssaguerre et al(25). Les syndromes de Brugada(26) du QT court(27,28) et de repolarisation précoce doivent bien être identifiés en raison du risque d’orages rythmiques qui peut être prévenu par la quinidine(29,30) ou par l’isuprel pour le Brugada et la repolarisation précoce(31). De même pour le syndrome de Brugada, certains QT longs et les torsades à couplage court, le recours à l’ablation des extrasystoles ventriculaires initiatrices peut permettre de diminuer les récidives de FV en situation d’orage rythmique(32).
S’ils sont parfois de diagnostic évident sur un ECG standard, ces syndromes sont en réalité difficiles à diagnostiquer en pratique quotidienne, faisant le plus souvent appel à des analyses ECG plus complexes et/ou à des tests pharmacologiques spécifiques. Chez les patients qui font partie de familles dont les mutations sont déjà identifiées, le diagnostic génétique peut constituer une aide importante. En l’absence de mutation connue dans la famille, cette recherche sera d’autant plus longue que le syndrome clinique n’est pas identifié. Une fois identifié, le diagnostic génétique devient très utile pour les membres de la famille des cas index. Il est donc souhaitable d’adresser les patients survivants et les membres de leur famille dans des centres référents habilités dans la prise en charge ces affections arythmiques héréditaires.
En pratique… Quel bilan ? Quels examens complémentaires ?
En pratique, après avoir éliminé une cause non cardiaque lors de l’évaluation initiale, le bilan d’une mort subite ressuscitée débute par un interrogatoire précis des témoins, un examen clinique, une échocardiographie et une coronarographie (figure 7).
Figure 7. Bilan étiologique d’une mort subite cardiaque de l’adulte. DSA: défibrillateur semi-automatique; ECG: électrocardiogramme; IRM: imagerie par résonance magnétique; SVP: stimulation ventriculaire programmée; VA: voie accessoire VD: ventricule droit
L’ensemble des examens ne sera pas obligatoirement réalisé chez tous les patients. La stratégie diagnostique recherche dans un 1er temps les causes les plus fréquentes, dans un 2e les causes plus rares, et enfin les causes exceptionnelles. Dans le même temps la démarche pragmatique cherchera à identifier les causes aiguës réversibles ou curables qui ne relèveront pas d’une indication de DAI.
L’enquête étiologique se doit d’être particulièrement rigoureuse et s’apparente à une enquête policière.
• Il est important de commencer par valider le diagnostic rythmique initial en réanalysant les tracés ECG initiaux et/ou du défibrillateur semi-automatique. En effet, un tracé de BAV sans échappement n’aura pas du tout la même signification qu’un tracé de FV.
• Le recueil des antécédents personnels (pathologies sous-jacentes, palpitations, syncopes, traitements habituels mais aussi récents…) et familiaux (notion de mort subite familiale) simplifiera grandement la démarche diagnostique ultérieure. Plus spécifiquement, le détail des circonstances de survenue sera particulièrement utile. En effet, une mort subite survenant à l’effort et/ou des antécédents de syncope d’effort feront évoquer une cardiomyopathie hypertrophique, une DVDA, un QT long congénital de type 1 ou 2, ou encore une TV catécholergique ; une mort subite pendant la nage, des noyades dans la famille feront évoquer un
QT long de types 1 ou 7 ou des TV polymorphes catécholergiques(33).
• Le bilan recherchera ensuite une atteinte cardiaque structurelle. L’échocardiographie doit être systématique, éventuellement répétée à distance de l’épisode. Elle permettra le diagnostic facile de cardiopathies évoluées qu’elles soient dilatées, hypertrophiques, restrictives, valvulaires ou congénitales, ainsi que les formes très évoluées de DVDA.
L’imagerie par résonance magnétique, pratiquée dans un deuxième temps, a facilité le diagnostic des myocardites et de la DVDA, même si le diagnostic des formes frustes de DVDA nécessite souvent d’être complétée par une scintigraphie de phase et/ou une angiographie ventriculaire droite.
Enfin, la coronarographie peut être répétée pour le test au méthergin en cas de suspicion de spasme coronaire, même si elle a été réalisée à la phase initiale. Ce bilan morphologique sera bien entendu impossible à réaliser si la réanimation initiale a été infructueuse et devra, dans l’idéal, être remplacée par une autopsie systématique(19).
• Les études fonctionnelles prennent toute leur importance en l’absence de cardiopathie objectivée, ou si les anomalies observées ne suffisent pas à elles seules à expliquer la mort subite. L’ECG standard permet de faire le diagnostic des formes caricaturales de la plupart des pathologies arythmiques héréditaires et des troubles conductifs de haut degré. Les ECG doivent cependant être répétés car les anomalies sont parfois labiles, masquées ou majorées par les traitements utilisés (i.e. allongement de l’intervalle QT ou majoration d’une repolarisation précoce au cours de l’hypothermie thérapeutique). L’enregistrement Holter ECG permet d’affiner le diagnostic des formes frustes de QT long, de même qu’il permet de documenter d’éventuelles extrasystoles ventriculaires à couplage court ou des modifications du segment ST en cas de spasme coronarien.
La recherche de potentiels tardifs ventriculaires est surtout réalisée en cas de suspicion de DVDA.
Le test d’effort peut s’avérer très informatif lorsque la mort subite survient à l’effort, ou en cas d’antécédents de syncopes ou de palpitations d’effort. Il est quasi pathognomonique dans les TV catécholergiques(24), et permet parfois de déclencher des TV monomorphes dans la DVDA. Enfin, il est parfois utile pour évaluer la dynamique de l’intervalle QT dans les formes frustres de QT long.
• L’étude électrophysiologique endocavitaire permet d’objectiver un trouble conductif auriculo-ventriculaire latent, de mettre en évidence une voie accessoire masquée, de déclencher des TV monomorphes infundibulaires ou fasciculaires, ou d’analyser le substrat des DVDA par des techniques de cartographie tridimensionnelle en voltage du ventricule droit. Des tests pharmacologiques peuvent également être réalisés au cours de cette étude (test à l’ajmaline pour démasquer un trouble conductif ou un syndrome de Brugada, test à l’isuprel ou à l’adrénaline pour les TV catécholergiques, test avec un bloqueur de courant potassique pour démasquer une forme frustre de QT long…).
• L’enquête génétique sera toujours réalisée en cas de diagnostic certain ou suspect de trouble rythmique héréditaire(9,19,20). Lorsqu’une mutation causale est identifiée chez le cas index, il devient alors facile de déterminer le statut des apparentés dans la famille considérée. Si la recherche de mutation responsable n’est pas orientée par une bonne caractérisation phénotypique, les résultats seront d’autant plus longs dans la mesure où l’hétérogénéité génétique est grande. À défaut, des prélèvements de cœur et de sang pour analyse génétique au cours de l’autopsie peuvent s’avérer utiles, en cas de mort subite inexpliquée non récupérée du sujet jeune.
Ce n’est que lorsque l’ensemble du bilan décrit ci-dessus est négatif que l’on parlera de mort subite idiopathique, une entité dont la part diminue avec la découverte de nouveaux syndromes et les progrès des outils diagnostiques.
En pratique
Le bilan étiologique de la mort subite est complexe.
Après quarante ans dominent les conséquences de l’athérosclérose coronaire, d’où la nécessité d’insister sur la prévention primaire qui se confond avec celle de l’athérosclérose coronaire.
Chez les sujets plus jeunes, la responsabilité est partagée entre les cardiomyopathies et les troubles rythmiques sous-tendus par des anomalies génétiques.
L’objectif de ce bilan est de déterminer la cause de la mort subite et d’optimiser la prise en charge individuelle ± familiale des patients. Pour être réalisé correctement, ce bilan doit commencer dès la phase initiale de leur prise en charge. Elle nécessite une étroite collaboration entre réanimateurs, angioplasticiens, rythmologues, généticiens, psychologues, spécialistes de la réadaptation et constitue un exemple parfait de filière de soins.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité