Valvulopathies
Publié le 26 juin 2007Lecture 11 min
Prise en charge d'un syndrome aortique aigu
J.-L. MONIN, CHU Henri Mondor, Créteil
Un syndrome aortique aigu (SAA) est caractérisé par une douleur thoracique brutale et intense, provoquée par une lésion organique de la paroi aortique(1). Cette entité se situe en dehors du contexte des polytraumatismes ; de ce fait, les ruptures de l’isthme aortique n’entrent pas dans ce cadre. Les étiologies de SAA sont dominées par la dissection aortique aiguë « classique » (90 % des cas, avec rupture de l’intima et faux chenal circulant) et l’hématome intrapariétal (5 à 10 % des cas, lié à la rupture d’un vasa vasorum sans déchirure intimale ni faux chenal circulant). Les autres causes sont plus rares, il s’agit de l’ulcère athéromateux pénétrant, des ruptures intimales localisées et des dissections iatrogènes(2).
Le Registre international des dissections aortiques aiguës (IRAD), regroupant 21 centres médico-chirurgicaux répartis dans 11 pays, a permis de recueillir des données épidémiologiques, cliniques et pronostiques sur plus de 100 patients depuis 1996(3,4). Ce registre apporte un regard neuf sur la prévalence des différentes étiologies, la sémiologie, la prise en charge et le pronostic des SAA en 2007.
Quelle classification ?
Intérêt de la classification de Stanford
La relativement récente classification de Svensson individualise 5 types de pathologies aortiques aiguës en fonction de l’étiologie (figure 1). Cependant, les types I et II (dissection classique et hématome intrapariétal représentent 98 % des causes de SAA ; cette nouvelle classification est donc peu utilisée.
Figure 1. Classification des SAA (adapté d’après Svensson et al. J Am Coll Cardiol 1999 ; 99 : 1331-6) : Classe I : dissection aiguë « classique » avec faux chenal circulant. Classe II : hématome intrapariétal aortique. Classe III : déchirure intimale localisée (sans création de faux chenal). Classe IV : ulcère athéromateux pénétrant. Classe V : dissection iatrogène (post-cathétérisme).
En pratique, la classification la plus utilisée demeure celle de Stanford :
- type A : toute dissection intéressant l’aorte ascendante ; le type A regroupant les type I et II de De Bakey ;
- type B : dissection débutant au pied de l’artère sous-clavière gauche, respectant la crosse et l’aorte ascendante (type III de De Bakey).
L’utilisation large de cette classification est justifiée par les implications pronostiques et thérapeutiques, radicalement différentes entre les types A et B (tableau 1).
Présentation clinique
Le symptôme majeur (présent dans 85 % des cas) devant faire évoquer le diagnostic est une douleur thoracique extrêmement brutale, d’emblée maximale, décrite comme la douleur la plus insoutenable jamais ressentie par le patient(1). Cette douleur est plus volontiers antérieure (71 % des cas) en cas de type A ; à l’opposé, elle est plutôt dorsale (63 % des cas) en cas de type B.
Le caractère migrateur de la douleur est relativement rare (17 % des cas) de même que la syncope (seulement 9 % des cas, plus fréquente dans le type A). Les signes d’examen retrouvés dans les dissections de type A sont : un souffle d’insuffisance aortique (44 % des cas), une pression artérielle systolique < 100 mmHg (11 %), voire des signes de tamponnade ou de choc (13 %). Dans le type B, la pression artérielle est volontiers plus élevée, > 150 mmHg dans 70 % des cas. En revanche, l’abolition des pouls est rare (15 %), plus fréquente dans le type A. De même, l’élargissement du médiastin est absent dans un tiers des dissections de type B (contre 17 % des types A) ; les anomalies ECG sont fréquentes et non spécifiques, l’ECG n’étant normal que dans un tiers des cas(1).
Quelle technique d’imagerie ?
En pratique, le scanner thoracique occupe la première place pour le diagnostic de dissection aortique. Curieusement, l’échographie transœsophagienne (ETO) de première intention n’est utilisée que dans un tiers des cas. Comparativement au scanner, l’ETO présente les avantages suivants :
- une mise en œuvre rapide au lit du patient,
- une imagerie dynamique (mobilité du voile intimal, différences de vitesses entre vrai et faux chenal),
- une localisation fiable de la porte d’entrée.
Ce dernier point est important en cas d’indication chirurgicale, notamment de porte d’entrée située sur l’aorte horizontale.
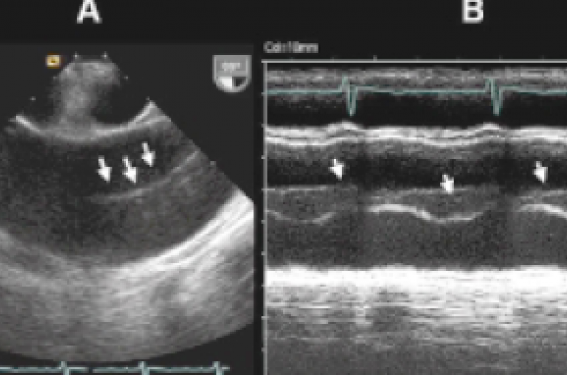
Concernant l’ETO, un piège diagnostique classique mérite d’être souligné : en cas de dilatation de l’aorte ascendante, des images arciformes de réflexion de l’interface aorte/oreillette gauche peuvent se projeter dans la lumière aortique et faire évoquer à tort le diagnostic de voile intimal. Les critères en faveur d’un artefact de réverbération sont les suivants :
- lignes arcifomes, floues, se raccordant mal aux parois aortiques,
- la mobilité de ces lignes (en TM) est rigoureusement parallèle aux mouvements des parois,
- les flux Doppler couleur ne sont pas séparés par ces lignes (figure 2).
Finalement, le choix entre scanner et ETO pour le diagnostic initial dépend des possibilités et de l’expertise locale du centre où le patient est admis. Les recommandations européennes (tableau 2)(11) émettent en premier choix l’ETO et le scanner, en soulignant l’avantage de l’ETO pour localiser la porte d’entrée ; l’IRM est proposée en second choix et les indications de l’angiographie sont nettement réduites, réservées aux patients dont l’hémodynamique est parfaitement stable et où les examens non invasifs n’ont pas pu conclure(11). L’angiographie de première intention est contre-indiquée, a fortiori chez un patient instable, de même pour la coronarographie systématique avant intervention chirurgicale urgente.
Figure 2. Artefact de réverbération de l’interface aorte/oreillette gauche sur une aorte dilatée en ETO : A : lignes arciformes, floues, se raccordant mal aux parois aortiques visibles sur une incidence aortique à 99° ; B : le mode TM montre une mobilité des lignes parallèle aux parois aortiques et auriculaire gauche.
Dissection aortique aiguë « classique » : critères diagnostiques
Le diagnostic de dissection aortique aiguë repose sur la présence de 4 critères(11) :
- présence d’un voile intimal intraluminal, dont la mobilité est indépendante des parois ;
- séparation de la lumière aortique par le voile intimal en deux chenaux distincts : vrai chenal et faux chenal, généralement plus large que le vrai chenal qu’il comprime (figure 3) ;
- mise en évidence de vitesses différentes des flux sanguins dans le vrai et le faux chenal (figure 3) ;
- localisation de la porte d’entrée sous la forme d’une rupture intimale faisant communiquer largement vrai et faux chenal.
La présence des 4 critères est indispensable pour affirmer le diagnostic de dissection vraie, type I de la classification de Svensson(2).
Figure 3. ETO : dissection aiguë de l’aorte ascendante (type A): A : le voile intimal (flèches), situé au ras de sinus de Valsalva sépare le vrai chenal (VC) du faux chenal (FC), siège d’un contraste spontané ; B : le Doppler couleur montre le flux circulant dans le vrai chenal, moulé par le voile intimal.
Hématome intrapariétal aortique : critères diagnostiques
En l’absence de voile intimal, de faux chenal circulant ou de porte d’entrée, le deuxième diagnostic à évoquer par ordre de fréquence est l’hématome intrapariétal aortique (HIP) ; l’ETO et l’IRM sont deux examens clés apportant des informations complémentaires pour ce diagnostic.
ETO
Épaississement circonférentiel ou localisé, en croissant, de la paroi aortique, mesurant généralement plus de 7 mm(12), de tonalité intermédiaire entre la paroi et le sang ; l’extension en hauteur est variable mais généralement moins importante que pour une dissection vraie (figure 4). La concavité de la paroi vers la lumière aortique est respectée et la zone de collection est généralement moins importante que la lumière aortique résiduelle.
Figure 4. ETO : hématome pariétal de l’aorte descendante (type B): A : épaississement en croissant de la paroi aortique dont l’épaisseur peut être mesurée (double flèche) ; B : le Doppler couleur montre l’absence de communication entre la lumière aortique et la zone d’hématome ; C : en coupe longitudinale, plusieurs zones liquidiennes sont visibles au sein de l’hématome, sans flux circulant.
Déplacement interne de calcifications intimales vers la lumière aortique.
Présence de zones liquidiennes apparaissant comme vides d’écho (figure 4) et faiblement circulantes en Doppler couleur. Ces zones correspondent au saignement intrapariétal récent, sans communication avec la lumière aortique ; la présence de ces zones liquidiennes est classique dans l’évolution d’un HIP et n’est pas un facteur de mauvais pronostic ni d’évolution vers une dissection vraie(13).
Absence de voile intimal, de porte d’entrée ou de faux chenal circulant.
Scanner thoracique/IRM
Les critères diagnostiques au scanner thoracique sont sensiblement les mêmes : épaississement pariétal aortique circonférentiel ou localisé en croissant avec prise de contraste faible ou inexistante, respect de la concavité vers la lumière aortique, déplacement de calcification pariétales (figure 5). Les critères négatifs sont également importants : absence de voile intimal ou de faux chenal circulant.
Figure 5. Scanner thoracique montrant un hématome pariétal de l’aorte descendante (type B). La coupe A est au niveau de l’aorte horizontale et montre un épaississement pariétal débutant avec l’aorte descendante. La coupe B montre l’aspect typique en croissant sur l’aorte descendante ; noter le déplacement de calcifications pariétales vers la lumière aortique (flèches).
Parfois, la distinction entre hématome pariétal et athérome aortique complexe peut être difficile. Dans ce cas, la meilleure résolution de l’IRM permet d’individualiser les différentes strates de la paroi aortique : l’hématome intrapariétal, sous-adventiciel, étant situé sous la plaque d’athérosclérose aortique. De plus, l’IRM apporte un critère diagnostique très spécifique : la présence d’hyper signal en T2, lié à la formation de méthémoglobine dans la zone d’hématome(14). Une synthèse des critères diagnostiques permettant de différencier l’hématome pariétal d’une dissection aortique vraie est donnée dans le tableau 3.
Pronostic et traitement(s) d’un SAA en 2007
Conduite à tenir
Tout patient suspect de SAA doit être hospitalisé d’urgence en unité de soins intensifs, de préférence dans un centre disposant de chirurgie cardiaque. Le traitement médical initial comporte un contrôle de la douleur (antalgiques majeurs par voie SC ou IV) et de la pression artérielle, dans le but de maintenir une PA systolique ≤ 110 mmHg (bêtabloquants et vasodilatateurs IV).
L’étape suivante est l’obtention rapide d’une ETO ou d’un scanner thoracique afin d’affirmer le diagnostic, préciser le type de lésion (dissection vraie ou hématome pariétal) et sa localisation selon la classification de Stanford. En cas d’atteinte de l’aorte ascendante (type A), le pronostic spontané est médiocre, qu’il s’agisse d’une dissection ou d’un hématome intrapariétal (mortalité spontanée de 30 à 50 %).
De ce fait, la stratégie thérapeutique est la même pour ces deux pathologies :
- en cas d’atteinte de l’aorte ascendante : la chirurgie doit être proposée en urgence en l’absence de contre-indication ;
- à l’opposé, en cas d’atteinte isolée de l’aorte descendante (type B) sans complication d’emblée : le traitement médical de première intention est licite(15).
Traitement : chirurgie vs techniques endovasculaires
Le but de la chirurgie dans les SAA de type A est de prévenir la rupture aortique et la tamponnade et de traiter l’insuffisance aortique. La technique la plus couramment employée est le remplacement de l’aorte ascendante, qui permet d’éliminer la porte d’entrée dans la plupart des cas. Une porte d’entrée située sur l’aorte horizontale peut nécessiter un traitement propre. La valve aortique peut être conservée dans certains cas. Cependant, en cas de syndrome de Marfan ou de bicuspidie aortique, la plupart des équipes pratiquent un replacement valvulaire systématique associé au remplacement de l’aorte ascendante. Malgré les progrès des techniques chirurgicales et d’anesthésie, la mortalité opératoire au stade aigu d’une dissection de type A reste lourde : de 15 à 25 % selon les séries et, globalement, le pronostic des types A est plus sévère que celui des types B (tableau 1).
Les techniques endovasculaires n’ont pas leur place actuellement dans les dissections de type A. En revanche, dans les dissections aortiques de type B, les endoprothèses couvertes de Goretex mises en place par voie artérielle sont actuellement en cours d’évaluation. Les principales indications sont la dilatation progressive de l’aorte ou l’ischémie de branches collatérales. Idéalement, la porte d’entrée et un segment suffisamment long d’aorte sont couverts par une ou plusieurs endoprothèses, permettant l’occlusion du faux chenal, l’expansion du vrai chenal et prévenant le remodelage anévrismal de l’aorte.
Principaux facteurs de risque : HTA et bicuspidie aortique
Le facteur de risque numéro 1 est l’hypertension artérielle, retrouvée dans 72 % des cas du registre IRAD(1) ; le patient hypertendu > 70 ans est le profil typique exposant aux dissections aortiques et hématomes intrapariétaux de type B (touchant l’aorte descendante)(1). Avant 70 ans, la bicuspidie aortique est un puissant facteur de risque de dissection aortique de type A (touchant l’aorte ascendante)(5). Il est actuellement établi que la bicuspidie est une maladie du culot aortique, caractérisée par une altération de la quantité et de la répartition des protéines interstitielles associée à une apoptose accélérée des cellules musculaires lisses, de manière comparable au syndrome de Marfan(6). L’hypothèse plausible en cas de bicuspidie est une fibrilline-1 déficiente dans le tissu interstitiel vasculaire, stimulant l’activité lytique des métalloprotéinases, avec fragilisation de la média favorisant l’apparition d’anévrisme et de dissection aortique(7). Les risques évolutifs de la bicuspidie sont donc proches de ceux du syndrome de Marfan.
De ce fait, les dernières recommandations européennes rapprochent ces deux pathologies en cas de dilatation de l’aorte ascendante : quel que soit le degré d’atteinte valvulaire aortique, le remplacement prophylactique de l’aorte ascendante est recommandé lorsque le diamètre aortique atteint 45 mm en cas de Marfan ou 50 mm en cas de bicuspidie ; le seuil décisionnel est toujours à 55 mm dans les autres cas(8).
Causes plus rares : syndrome de Marfan et cocaïne
Tous les phénomènes fragilisant la média aortique sont susceptibles de favoriser l’émergence d’un SAA. Parmi les étiologies classiques, le syndrome de Marfan (mutation du gène de la fibrilline-1, incidence = 1/7 000) reste une cause reconnue de SAA bien que relativement rare. Plus récemment, l’utilisation de cocaïne (fumée sous forme de crack) a été mise en cause dans plus d’un tiers des cas sur une série de 38 dissections aortiques répertoriées dans un hôpital de San Francisco(9). La population concernée était essentiellement de race noire avec une HTA ancienne et négligée ; la dissection survient généralement dans les 12 heures suivant la consommation de crack, favorisée par la libération massive de catécholamines endogènes(9).
Par ailleurs, la grossesse a longtemps été considérée comme un facteur favorisant l’apparition d’une dissection. Les données récentes du registre IRAD semblent contredire cette notion, puisqu’au sein même des patientes atteintes de syndrome de Marfan, la survenue d’une dissection n’a pas été influencée par la grossesse, mais plutôt par la taille de l’aorte ascendante(10).
En pratique
La suspicion d’un SAA est une urgence absolue devant entraîner le transfert rapide par le moyen le plus approprié vers un centre disposant des techniques d’imagerie appropriées (ETO/ scanner ou IRM) et de la chirurgie cardiaque.
L’hématome intrapariétal représente 5 à 10 % des syndromes aortiques aigus. La physiopathologie et la sémiologie radiologique de cette entité en font une maladie à part, l’évolution vers une dissection vraie survenant dans moins d’un cas sur deux. Toutefois, le pronostic spontané de cette entité étant proche de celui d’une dissection vraie, la conduite à tenir est identique.
Une fois le diagnostic de dissection aortique ou d’hématome intrapariétal établi, la décision thérapeutique repose essentiellement sur la classification de Stanford :
- chirurgie en urgence pour les dissections ou hématome pariétal de l’aorte ascendante (type A),
- traitement médical de première intention pour les dissections ou hématome pariétal débutant après la sous-clavière gauche (type B).
Malgré la mise en œuvre d’un traitement adapté, la mortalité intrahospitalière reste lourde, de l’ordre de 20 à 30 %. L’amélioration du pronostic repose sur une meilleure diffusion des connaissances les plus récentes et des algorithmes décisionnels concernant les syndromes aortiques aigus.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :