Publié le 22 mar 2015Lecture 4 min
Une amylose cardiaque, jusqu’où aller dans le diagnostic et le traitement ?
Y. COTTIN, S. HOUAMRIA, V. LEGUY, L. DUFOUR, C. RICHARD, J.-C. EICHER, CHU de Dijon
M. G..., âgé de 75 ans, cyclotouriste effectuant habituellement 10 000 à 12 000 km par an, est hospitalisé pour un bilan dans les suites d'un malaise survenu à l'effort en Lituanie et d’une dyspnée d’effort stade II évoluant depuis plusieurs mois.
Ce patient présente comme seul facteur de risque, hormis son sexe et son âge, un tabagisme modéré sevré évalué à 8 paquets/année. Il faut souligner que le bilan pneumologique avec EFR s'est révélé négatif. L’ECG met en évidence une HVG modérée, et l'échographie cardiaque (figures 1 à 3) une bonne contractilité segmentaire et globale, avec aspect de CMH circonférentielle assez sévère, mesuré à 18 mm au niveau du septum IV avec un aspect hyperbrillant. L’épreuve d'effort s’avérant litigieuse, une scintigraphie myocardique est réalisée et montre une discrète hypofixation de la partie basale de la jonction inféro-basale.
Figure 1.
Figure 2.
Figure 3.
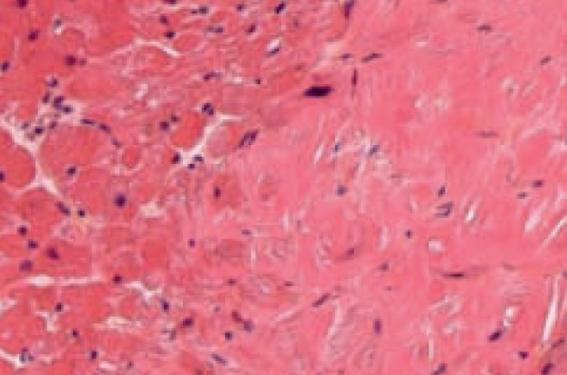
La coronarographie met en évidence un réseau coronaire infiltré, athéromateux et calcifié, mais sans lésion significative, en revanche, la ventriculographie montre un aspect de CMH très marqué (figure 4). Le bilan est alors complété par une IRM myocardique (figure 5) évocatrice d'une amylose cardiaque. L’absence de chaînes légères libres sériques nécessite un approfondissement des explorations diagnostiques. La biopsie des glandes salivaires et celle de la graisse sous-cutanée réalisée dans un second temps reviennent négatives. Par contre, une PBO met en évidence un îlot graisseux portant une amylose de type AL. Le diagnostic est confirmé par une biopsie myocardique avec des dépôts extracellulaires finement craquelés entre les myocytes, éosinophiles à la coloration par l’HES (figure 6) et des dépôts prenant une coloration rouge groseille à la coloration par le rouge Congo, substance amyloïde (figures 7 et 8).
Figure 4.
Figure 5.
Figure 6.
Figure 7.
Figure 8.
Discussion
Cette observation permet de discuter les critères diagnostiques, les thérapeutiques et le pronostic de l’amylose cardiaque (AC). L’amylose cardiaque regroupe plusieurs entités cliniques ayant en commun le dépôt extracellulaire de protéines fibrillaires agencées en feuillets plissés. L’AC est plus fréquente au cours de l’amylose AL et constitue un exemple classique de cardiomyopathie restrictive. C’est, de plus, une affection non exceptionnelle qui représente 5 à 10% des cardiopathies non ischémiques. Elle est de mauvais pronostic. Ainsi, ce sont plus de 600 nouveaux cas qui sont répertoriés chaque année, avec un pic de fréquence entre 60 et 70 ans, en revanche l’AC reste exceptionnelle avant 40 ans. L’insuffisance cardiaque représente la circonstance de découverte la plus classique, entre 60 et 70% des cas, mais cette dernière traduit une forme sévère et avancée, comme c’est le cas dans notre observation. L’angor est la deuxième manifestation clinique, retrouvé dans 25% des cas, et des observations de pseudo-nécrose ont également été publiées. Enfin, une hypotension orthostatique a été décrite dans 16 % des cas.
L’ECG est pathologique dans plus de 90% des cas et peut montrer :
a) un microvoltage contrastant avec l’HVG échographique ;
b) un aspect de pseudo-nécrose antérieure ;
c) une déviation axiale droite ou gauche ;
d) des troubles rythmiques ou conductifs.
Mais c’est l’échocardiographie qui reste l’examen majeur avec la mise en évidence d’une HVG prédominant habituellement sur le septum, associée à un aspect granité, brillant. De plus, l‘association à un profil restrictif et à un épanchement péricardique peut rapidement suggérer le diagnostic d’amylose. Enfin, il faut souligner que les thromboses intracardiaques sont fréquentes, même chez les patients en rythme sinusal, et qu’elles doivent être systématiquement recherchées. À côté de l’échocardiographie, l‘IRM avec injection de gadolinium est caractérisée ici par un rehaussement tardif sous-endocardique.
Rechercher les autres localisations
Parallèlement, le cardiologue doit systématiquement rechercher d’autres localisations, en particulier rénale. En effet, dans 50% des cas, les patients présentent une atteinte rénale, avec le plus souvent un syndrome néphrotique ou une thrombose des veines rénales. La seconde localisation extracardiaque est l’atteinte pulmonaire avec un syndrome interstitiel diffus ou une atteinte nodulaire à la radiographie pulmonaire. Enfin, les atteintes digestives sont courantes avec en particulier des macroglossies, des dysphagies liées à la neuropathie végétative, ou des atteintes du grêle.
Une des originalité de notre dossier est qu’aucune localisation extracardiaque n’a été mise en évidence.
Le diagnostic de certitude repose sur l’histologie qui met en évidence, grâce à la coloration par le rouge Congo, la protéine amyloïde, en revanche, les techniques immuno-histochimiques permettent de caractériser le type. Trois sites sont préférés : la biopsie rectale, l’aspiration de la graisse sous-cutanée abdominale et la biopsie des glandes salivaires accessoires. Dans notre observation, la biopsie des glandes salivaires et celle de la graisse sous-cutanée sont revenues négatives, une biopsie endomyocardique a donc été réalisée et a apporté la confirmation diagnostique.
Le traitement de l’amylose AL repose sur deux axes :
a) le traitement général de l’amylose ;
b) le traitement spécifique de l’amylose cardiaque.
Le traitement général consiste en une corticothérapie type prednisone, associée à un alkylan, dans certains cas une autogreffe de moelle peut être discutée. Le traitement de l’amylose cardiaque sera d’abord celui de l’insuffisance cardiaque, en gardant en mémoire que les bêtabloquants et la digoxine sont fortement déconseillés, de même que les anticalciques bradycardisants. De fortes doses de diurétiques sont en général nécessaires pour contrôler les signes congestifs. Il faut noter que dans de nombreux cas la chimiothérapie entraîne une réduction des signes cliniques et/ou des anomalies cardiaques et plus particulièrement une régression de la CMH. Le pronostic de cette maladie reste sévère, avec une médiane de survie de 13 mois après le diagnostic et de seulement 6 mois en cas d’atteinte cardiaque en l’absence de traitement.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité