Publié le 14 avr 2015Lecture 10 min
L’écho-Doppler : son rôle essentiel dans l’insuffisance cardiaque
C. VINCENT-TOUCHE, CHU de Bordeaux

Les nouvelles techniques que sont le 3D et le strain apportent des informations complémentaires dans l’analyse échographique des patients insuffisants cardiaques.
Évaluation de la fonction systolique par les nouvelles techniques dans l’insuffisance cardiaque
D’après B. Diébold, Paris
Les nouvelles techniques que sont le 3D et le strain apportent des informations complémentaires dans l’analyse échographique des patients insuffisants cardiaques. D’une part, les nouvelles sondes 3D permettent de mesurer la fraction d’éjection en 3D et de confirmer la mesure réalisée en 2D ainsi qu’une mesure plus précise des volumes ventriculaires. En cas de mauvaise échogénicité, le recours au produit de contraste (Sonovue) peut s’avérer utile. D’autre part, le speckle tracking ou strain 2D ainsi que le strain 3D apportent des éléments sur la sévérité et le pronostic des cardiomyopathies. Ces techniques présentent cependant des limites (champ trop petit pour les ventricules dilatés, techniques de strain non encore consensuelles, échogénicité en 3D, fibrillation atriale et autres troubles du rythme).
Place de l’échocardiographie et de l’imagerie multimodalité dans la resynchronisation biventriculaire
D’après E. Abergel, Bordeaux
L’étude PROSPECT(1) a montré une très mauvaise reproductibilité des différents critères d’asynchronisme et chacun des indices pris individuellement avait une sensibilité et une spécificité trop basses pour permettre de prédire le succès de la resynchronisation.
En effet, l’évaluation de l’asynchronisme se décline à plusieurs étages et doit être multiparamétrique(2) :
- asynchronisme atrio-ventriculaire comparant la durée du flux mitral et l’intervalle R-R avec un seuil ≤ 40 % ;
- asynchronisme interventriculaire avec comparaison des délais prééjectionnels aortique et pulmonaire avec un seuil ≥ 40 ms ;
- asynchronisme intra-VG, et notamment temporel, avec recherche d’un recouvrement systolo-diastolique (temps entre le début du QRS et la contraction de la base de la paroi antérolatérale en 4C – temps entre le début du QRS et le début du flux transmitral en Doppler pulsé ≥ 0 ms).
Les recommandations européennes de 2013(3) sur les critères de sélection à la resynchronisation sont une FEVG ≤ 35 % et une largeur de QRS > 120 ms ou > 150 ms. Cependant, sur la base de ces recommandations, un tiers des patients ne seront pas répondeurs à la resynchronisation.
En effet, le manque de reproductibilité des mesures est une limite importante de l’écho : paramètres d’asynchronisme, notamment intra-VG spatial en DTI, durée des QRS, et mesure de la FEVG.
Les leçons que l’on peut tirer de PROSPECT :
- tenir compte de l’asynchronisme intra-VG temporel mais aussi de la qualité de contraction myocardique des parois tardives (en faisant du TM anatomique sur la collerette basale antérolatérale permettant de voir le retard de contraction de la paroi alors que la valve mitrale est déjà ouverte) ;
- différencier asynchronisme avec substrat électrique en faveur d’une resynchronisation efficace d’un substrat mécanique type ischémie ou fibrose qui irait à l’encontre d’une resynchronisation efficace. Le signe de la présence d’un BBG est la présence d’un raccourcissement prééjectionnel du septum ou septal flash : en TM en protosystole, mouvement d’invagination pendant la contraction isovolumique, mouvement actif modulé par les variations de pression entre le ventricule gauche et droit ; on peut aussi illustrer la présence d’un BBG par le strain avec mouvement de raccourcissement du septum ;
- prudence du résultat de la resynchronisation avec un seul paramètre, nécessité d’une approche multiparamétrique. L’approche multiparamétrique peut se faire en IRM : mesure de la FEVG, extension et localisation de la fibrose grâce aux rehaussements tardifs.
En conclusion, le profil du patient répondeur idéal présenterait : plusieurs critères d’asynchronisme AV et inter-V, un septal flash, une paroi latérale tardive ; un VG altéré mais non effondré, peu ou pas de séquelles VG, notamment en latéral ; un bon VD et un DAV optimisé.
Impact des techniques d’imagerie sur la prise en charge thérapeutique de l’insuffisance cardiaque
D’après F. Picard, Bordeaux
L’imagerie multimodalité(4) a un rôle essentiel dans la prise en charge diagnostique, pronostique et thérapeutique de l’insuffisance cardiaque systolique.
Sur le plan diagnostique, le gold standard pour l’étude de la morphologie cardiaque est l’IRM cardiaque, celui pour l’étude de la fonction diastolique est l’échocardiographie.
L’approche pronostique est multiparamétrique : FEVG, présence d’une cause ischémique (CMI et non CMD idiopathique), atteinte VD, présence d’une IM, importance d’une séquelle d’infarctus (et taille du rehaussement tardif [RT] à l’IRM) et SLG. Ces éléments sont apportés par l’échocardiographie et l’IRM.
Au niveau thérapeutique, le traitement pharmacologique doit être écho-guidé.
L’IRM permet de mieux guider l’implantation des défibrillateurs (meilleure réponse en l’absence de cicatrice en postérolatéral, la région où sera implantée la sonde de resynchronisation). L’échographie guide dans la sélection(5) (FEVG et FEVD, géométrie du VD) et le suivi des assistances (optimisation du débit d’assistance selon données ETT et évaluation de la récupération de la FEVG).
Au total, les deux examens clés qui sont actuellement recommandés dans la prise en charge de l’insuffisance cardiaque sont l’échocardiographie et l’IRM cardiaque. Il existe cependant toujours des questions en suspens :
- quelle technique permet la meilleure stratification du risque pour les CMD ?
- comment améliorer la sélection et optimiser les implantations dans les resynchronisations ?
- quel est le rôle de la scintigraphie myocardique et plus récemment du PET ?
- quel est le meilleur algorithme d’utilisation des différentes techniques dans la démarche diagnostique et pronostique ?
Insuffisance cardiaque à fraction d’éjection conservée : nouveaux aspects
D’après E. Donal, Rennes
Les recommandations incitent à utiliser l’échographie pour suivre les patients insuffisants cardiaques.
Pour faire le diagnostic d’IC à FSC(4), il faut :
- une FE ≥ 50 % ;
- la mise en évidence d’anomalies de la fonction diastolique en utilisant le rapport E/e’ ou le e’ ;
- un volume de l’OG ≥ 34 ml/m2 ;
- et éventuellement une masse VG augmentée, > 95 g/m2 chez les femmes et > 115 g/m2 chez les hommes.
Il est important de combiner le volume de l’OG au rapport E/e’ pour évaluer les pressions de remplissage et le degré de dysfonction diastolique.
L’étude KAREN sur les patients avec IC à FSC a montré la prévalence de l’HTA, de la FA, de l’anémie, de l’insuffisance rénale, du diabète et des pathologies pulmonaires(6,7).
Il existe une grande hétérogénéité des patients avec IC à FSC et il a été mis en évidence 3 phénotypes dans l’IC à FSC :
- patients avec dyspnée d’effort ;
- patients avec surcharge volumique ;
- patients avec insuffisance cardiaque droite.
Dans l’étude KAREN, les facteurs pronostiques mis en évidence en analyse univariée sont :
- la V max de l’IT avec un cutoff de 2,8 m/s ;
- le niveau de dysfonction du VD avec un cut-off de FRS de 35 % ;
- une valeur de SLG avec un cutoff de -16 % ;
- le rapport E/e’ avec un cut-off de 13 ;
- la présence d’une HVG.
En analyse multivariée dans KAREN, E/e’, l’HVG et la fuite tricuspide sont les paramètres pronostiques de l’IC à FSC.
Myocardiopathie hypertrophique : nouveaux concepts
D’après P. Réant, Bordeaux
La myocardiopathie hypertrophique (MCH) a été le sujet de recommandations récentes(8), avec des nouveautés au niveau de la prise en charge génétique, de l’apport de l’IRM et de l’échographie d’effort et de la prise en charge du risque de mort subite. Selon les dernières recommandations(8), le dépistage familial avec ECG et ETT est recommandé tous les 18 mois entre 8 et 18 ans et tous les 3 à 5 ans après 18 ans.
Le dépistage génétique est une recommandation de niveau IB, il doit être réalisé par une équipe multidisciplinaire spécialisée, dans un centre de compétence. Les tests de nouvelle génération sont beaucoup plus rapides, avec des résultats en 6 à 8 mois.
L’IRM apporte une confirmation diagnostique, notamment quand il existe une mauvaise fenêtre ultrasonore, et permet une mesure plus précise des épaisseurs et de la masse VG, la recherche d’une HVD, d’anévrismes apicaux, de thrombi et d’anomalies des muscles papillaires.
L’IRM permet la caractérisation tissulaire avec la présence de rehaussements tardifs (RT) chez 65 % des patients porteurs de MCH, classiquement au niveau des points d’insertion du VD et à mi-paroi des zones d’HVG. Les diagnostics différentiels peuvent être écartés : RT au niveau de la paroi latérale dans la maladie de Fabry, RT sous-endocardique et circonférentiel diffus dans l’amylose AL, mais plus transmural et plus diffus dans l’amylose à TTR d’origine génétique.
Les nouveaux concepts de caractérisation tissulaire en IRM sont le T1 mapping et la mesure du volume extracellulaire (VEC)(9), en utilisant l’hématocrite du jour : le VEC est particulièrement augmenté dans l’amylose alors qu’il est diminué dans le septum dans la maladie de Fabry ou dans les surcharges en fer. Le T1 mapping témoigne de la fibrose diffuse alors que les RT donnent des informations de fibrose localisée.
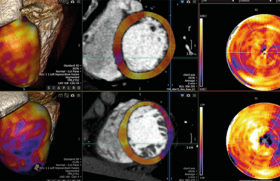
L’IRM a aussi l’intérêt de mettre en évidence des anomalies infracliniques(10) (figure) : FEVG plus élevée, volumes VG télésystoliques diminués, cryptes (invaginations du myocarde présentes dans 30 % des cas mais observées aussi de manière physiologique chez les sujets sains dans 8 % des cas), élongation du feuillet antérieur de la valve mitrale (23 mm versus 19 mm chez le sujet sain) ainsi que des trabéculations apicales.
MCH avec altération du strain longitudinal.
Les nouvelles recommandations mettent en évidence l’importance de réaliser une échographie d’effort quand le patient est symptomatique avec un gradient < 50 mmHg au repos pour rechercher une obstruction dynamique et évaluer une IM. Au niveau de la prise en charge thérapeutique, l’évaluation du risque rythmique fait appel à 5 critères majeurs qui sont un antécédent (ATCD) familial de mort subite avant 50 ans, un septum ≥ 30 mm, la présence de TVNS au holter, une syncope inexpliquée, une mauvaise adaptation tensionnelle à l’effort. Il existe un nouveau score recommandé dans les guidelines avec l’âge, l’épaisseur maximale de la paroi, le diamètre de l’OG (en PSGA), le gradient max d’obstruction (au repos et à l’effort), un ATCD familial de mort subite (MS) avant 40 ans, la présence de TVNS et d’une syncope. Chacun de ces paramètres est corrélé à un coefficient. Il existe une application smartphone permettant de mesurer ce score qui donne une évaluation du risque de mort subite. Quand ce score est < 4 %, le risque de MS est faible et le DAI est généralement non indiqué, s’il est entre 4 et 6 %, le DAI peut être considéré, s’il est ≥ 6 %, le DAI doit être considéré.
Les rehaussements tardifs semblent plus prédictifs d’une mortalité cardiovasculaire par insuffisance cardiaque que par risque rythmique(11).
Dans une étude récente(12), réalisée par l’oratrice, après analyse uni- et multivariée, 5 paramètres apparaissaient prédicteurs indépendants des décès CV et thérapies appropriées du DAI : TVNS, stade NYHA III-IV, VTS, SLG ≤ 14 %, gradient d’obstruction ≥ 30 mmHg de repos.
La maladie de Fabry et amylose : quand et pourquoi les rechercher ?
D’après T. Damy, Créteil
La maladie de Fabry est une maladie de surcharge lysosomiale, maladie génétique rare, récessive liée à l’X avec un déficit en alpha-galactosidase aboutissant à un dépôt intracellulaire. Elle est connue pour se déclarer chez le jeune adulte par une insuffisance rénale, des AVC, des acroparesthésies, des angiokératomes et une CMH. L’âge moyen de diagnostic est de 29 ans.
L’amylose(13) est une maladie systémique avec dépôts de substances amyloïdes avec infiltrat extracellulaire avec principalement 2 formes, AL et à transthyrétine. Les amyloses AL sont liées principalement aux gam mapathies monoclonales (MGUS) ou myélomes. Cette forme représente 60 % des amyloses. Les amyloses à transthyrétine sont de deux types :
- forme dite sénile ;
- forme héréditaire (autosomique dominant).
Selon le type de mutations, on aura des phénotypes différents : avec notamment la mutation Val30Met chez le Portugais avec décès due à une tétraplégie vers 30-40 ans avec atteinte initiale de type neuropathie ainsi que la mutation Val 122lle chez l’Africain (touchant 4 % des Afro-Américains) avec atteinte initiale cardiaque, HVG et décès de cause CV (mort subite ou IC). L’amylose sénile touche plus de 25 % des cas chez les patients après 85 ans.
L’atteinte cardiaque dans l’amylose est diffuse avec risque de troubles de la conduction, de tamponnade et d’accidents thromboemboliques par FA. Les manifestations extracardiaques des amyloses sont la neuropathie périphérique, une dysautonomie, des ecchymoses péri-orbitaires, un syndrome du canal carpien, un canal lombaire étroit, un syndrome néphrotique, une macroglossie.
Le strain longitudinal global permet de différencier ces 2 pathologies avec dans la maladie de Fabry, un SLG plus altéré au niveau de la paroi latérale et inférolatérale et au niveau de l’amylose AL, un strain altéré sur toutes les parties basales avec aspect d’« apical sparing » (apex préservé, dépôt d’amylose prédominant au niveau basal).
Un strain < -12 % est un indice de mauvais pronostic.
L’IRM dans l’amylose montre un RT sous-endocardique circonférentiel, soit diffus, soit focal. Le RT dans la maladie de Fabry prédomine en inférolatérobasal. Le T1 mapping permet de différencier les maladies de Fabry avec temps de relaxation bas des amyloses avec temps de relaxation haut.
La scintigraphie osseuse montre une hyperfixation cardiaque importante dans les amyloses à TTR et séniles (donc en cas de non-fixation cardiaque, cela est en faveur d’une amylose AL).
Flash d’actualité : facteurs prédictifs de l’insuffisance cardiaque dans la cardiopathie hypertensive
D’après P. Gosse, Bordeaux
L’HTA est un facteur de risque d’insuffisance cardiaque du fait notamment de l’HVG, des anomalies de remplissage et de l’altération de la fonction systolique.
Le 2D strain est intéressant pour mettre en évidence le lien de continuité qu’il existe entre HTA et insuffisance cardiaque.
En effet, il existe une réduction du strain longitudinal dans la cardiopathie hypertensive, avec un parallélisme entre degré d’HVG initial, diminution du SLG et augmentation de la fibrose(14).
La valeur du SLG en tant que prédicteur de risque d’insuffisance cardiaque chez l’hypertendu reste à démontrer mais paraît aujourd’hui un outil important pour la recherche clinique et déjà peut-être pour la pratique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité