Coronaires
Publié le 29 mai 2018Lecture 12 min
Que reste-t-il de la resténose ?
Romain CADOR, Hôpital Saint-Joseph, Paris
Pendant de longues années, la resténose a été le talon d’Achille de l’angioplastie, influençant notre prise en charge des patients coronariens, tant dans le choix du mode de revascularisation que dans notre rythme de surveillance au décours du geste d’angioplastie. Le recours systématique aux stents actifs a permis d’effondrer leur fréquence de survenue.
Il n’en demeure pas moins que leur prise en charge reste complexe et, surtout, que la nouvelle physiopathologie qui leur est associée nous impose de modifier notre logiciel de surveillance.
La définition d’une resténose reste angiographique à savoir une obstruction luminale supérieure à 50 % située au sein d’un stent et dans les 5 mm de part et d’autre du stent.
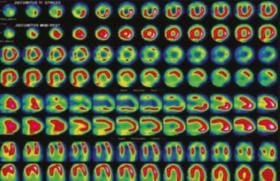
La classification de Mehran (figure 1), rarement utilisée, permet cependant d’insister sur le pronostic très variable selon que la resténose est focale ou diffuse, et reste probablement d’actualité à l’ère des stents actifs.
Figure 1. Classification de Mehran.
Si la resténose a considérablement été réduite par les stents actifs, sa fréquence angiographique reste d’environ 12 % (contre 20-30 % pour les stents nus) dans les plus grands registres avec un TLR compris entre 5 et 10 %. De plus, l’augmentation constante des angioplasties et le traitement de lésions de plus en plus complexes expliquent qu’elle n’ait pas déserté nos salles de coronarographie.
Plus grave, cette resténose reste un facteur indépendant de mortalité et la plupart des études s’accordent sur le fait que la resténose intrastent actif est certes plus rare mais plus grave que la resténose intrastent nu avec notamment une présentation clinique instable plus fréquente.
Mécanismes de la resténose
Historiquement, les mécanismes aboutissant à la survenue d’une resténose après angioplastie au ballon étaient triples : retour élastique précoce ou recoil, remodelage vasculaire tardif et hyperplasie intimale.
Si les deux premiers facteurs ont été solutionnés par l’implantation d’un stent, l’hyperplasie intimale, réponse inflammatoire non spécifique à la blessure pariétale vasculaire est bien au contraire aggravée par le stress persistant exercé par les mailles métalliques du stent.
L’hyperplasie intimale reste le mécanisme principal
La genèse de cette hyperplasie est bien connue. Dans les premiers jours, leucocytes et macrophages développent une réaction inflammatoire au site d’implantation du stent. Puis, selon un processus s’étalant sur 1 à 6 mois, initié par le stress pariétal avec rupture de la limitante élastique interne (LEI) et dissection de la média, les cellules endothéliales endommagées, les cellules musculaires lisses et les macrophages libèrent des facteurs de croissance et des cytokines qui engendrent une prolifération dans l’intima de cellules musculaires lisses après migration de celles-ci depuis la média et l’adventice. Enfin, cette néo-intima est consolidée par de la matrice extracellulaire qui solidifie la néo-intima (figure 2).
Figure 2. Image OCT de resténose intrastent nu typique constituée d’hyperplasie néointimale riche en cellules musculaires lisses.
La prolifération néo-intimale est associée parallèlement à un processus de réendothélialisation. L’ensemble de ce processus évolutif dure environ 6 mois.
Les endoprothèses actives, en libérant une chimiothérapie censée bloquer cette prolifération cellulaire, permettent une réduction significative de la resténose.
Toute la prise en charge des suites de l’angioplastie — et notamment la date de réalisation du test d’ischémie de contrôle — a été pendant très longtemps conditionnée par ce fameux délai au-delà duquel plus rien ne pouvait plus arriver !
Un nouvel acteur : la « néoathérosclérose »
Le suivi à très long terme des angioplasties avec stents nus et surtout celui des angioplasties avec stents actifs nous a permis de découvrir un nouvel acteur dans un processus désormais moins prévisible : la « néoathérosclérose ».
Il s’agit d’une accumulation à l’intérieur de la néo-intima de cellules spumeuses macrophagiques associées à des noyaux nécrotiques et parfois des calcifications.
Les mécanismes sont peu clairs : régénération incomplète de l’endothélium à l’origine d’un passage excessif de lipides circulants accélérant l’athérosclérose de la néo-intima, inflammation chronique favorisée par le polymère et le stent, responsabilité potentielle de la chimiothérapie dans la régénération incomplète de l’endothélium.
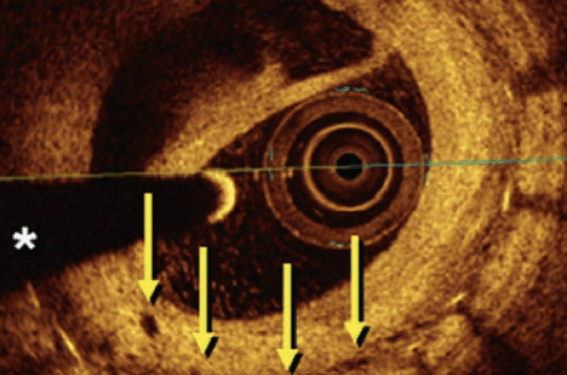
Ce phénomène qui se développe après plusieurs mois ou plusieurs années, et qui est plus fréquent après l’implantation d’un stent actif, est parfois responsable d’épisodes de thrombose aiguë. Sa mise en évidence a été rendue possible grâce à des études d’imagerie endocoronaire, principalement OCT, visualisant des bandes de tissus hétérogènes au sein de la prolifération intimale souvent associée à des ruptures intimales, des calcifications (figure 3), etc.
Figure 3. Image OCT de resténose intrastent actif avec néoathérosclérose.
L’analyse autopsique menée par Nakazawa sur 406 stents posés chez 299 patients a confirmé la nature histopathologique de cette néoathérosclérose tout en précisant sa prévalence et son délai de survenue ; celle-ci est retrouvée dans 31 % des stents actifs (TAXUS™ et CYPHER™) et 16 % des stents nus (p < 0,001). Sa survenue est beaucoup plus précoce en cas d’endoprothèses actives (délai d’implantation moyen respectivement de 420 et 2 160 jours (p < 0,001) (figure 4).
Figure 4. Prévalence et délai de survenue de la néo-athérosclérose.
La resténose à laquelle nous sommes confrontés est donc probablement très différente de celle que nous avions l’habitude de rechercher avec un potentiel thrombotique majoré (tableau 1).
Cela nous imposera probablement de changer le mode de surveillance de nos patients. Le test d’ischémie à 6 mois à la recherche d’une resténose exceptionnelle mais aussi souvent plus tardive n’a probablement plus de sens.
Facteurs prédictifs d’une resténose
Les facteurs prédictifs historiques de la resténose intrastent se retrouvent bien évidemment avec les endoprothèses actives.
• Parmi ceux liés au patient, le diabète et le sexe féminin ressortent toujours comme des facteurs indépendants de mauvais pronostic.
• Les lésions complexes (lésions longues, B2/C, ostiales, bifurcations, artères de petit calibre et athérome multitronculaire) ont bien évidemment pleinement profité des endoprothèses actives mais restent associées à un risque accru de resténose.
• Les nouvelles générations de stents actifs avec leur nouvel alliage, leur type de polymère moins inflammatoire et leur épaisseur de maille très fine) sont bien évidemment à privilégier, sans bénéfice formel entre les endoprothèses avec polymères résorbables ou non.
• Les facteurs liés à la procédure jouent probablement un rôle fondamental ce qui les distingue également des resténoses intrastent nus.
Au premier rang on retrouve la sous-expansion et la malapposition qu’elle soit aiguë ou secondaire (remodelage positif de l’artère, régression de la plaque d’athérome ou du thrombus ou recoil chronique du stent).
Dans un registre analysant 348 resténoses intrastent actif sous IVUS, Kang a ainsi retrouvé une hyperplasie intimale supérieure à 50 % chez presque tous les patients (93 %), mais aussi une sous-expansion du stent chez 42 % d’entre eux.
Traitement de la resténose intrastent actif
Plusieurs traitements autres que l’angioplastie au ballon seul ont été tentés et évalués dans le traitement de la resténose intrastent, avec stent nu ou actif, avec des succès très inégaux.
Le cutting balloon
Le cutting balloon, notamment le FLEXTOME™ Cutting Ballon développé par Boston Scientific est un ballon d’angioplastie muni de lames latérales dont l’intérêt théorique est d’assurer un découpage linéaire d’une matrice fibreuse afin d’en faciliter son angioplastie.
En pratique, il permet surtout un ancrage du ballon dans la lésion en évitant « l’effet savonnette » ou slippage souvent observé dans les lésions fibreuses et denses.
Après des études pilotes intéressantes, il a été principalement évalué dans l’étude randomisée RESCUT versus ballon nu.
Cette étude qui a inclus 428 patients présentant une resténose intrastent nu n’a pas permis de dégager de bénéfice clinique ou angiographique.
Il reste cependant un outil de préparation intéressant d’une lésion de resténose intrastent dense et résistante au ballon seul, mais avant utilisation d’un ballon actif ou d’un stent actif.
Son profil et son prix restent cependant les principales limites à une utilisation plus fréquente.
Le Rotablator™
Toujours dans un esprit de debulking d’une lésion dense et résistante, le traitement par Rotablator™ semble être conceptuellement intéressant.
En recours seul, il n’a cependant pas démontré de supériorité par rapport au ballon dans les études ROSTER et surtout ARTIST.
On peut, là encore, regretter qu’il n’ait pas été évalué en complément d’une implantation d’un nouveau stent actif dans cette indication.
Une autre indication niche pourrait être, entre des mains entraînées, le traitement de la resténose intrastent dans une endoprothèse dont le déploiement incomplet résisterait à une angioplastie à très fortes pressions par des ballons non compliants ou OPN.
Le ballon actif
Le ballon actif est un ballon d’angioplastie simple sur lequel est appliqué une substance associant un excipient capable d’assurer une cinétique de relargage lent à un principe actif qui lui est associé.
La molécule active est toujours le paclitaxel en raison de sa lipophilie et de ses propriétés pharmacodynamiques.
Développé depuis 2009, il offre une alternative thérapeutique séduisante au stent actif en évitant une couche de métal supplémentaire et en réduisant la durée de la bithérapie au décours.
Le ballon actif le plus évalué est le SeQuent® Please (désormais SeQuent® Please Neo) développé par la société B/Braun utilisant comme matrice de transport l’iopromide et la technologie Paccocath®.
Dans la resténose intrastent nu, les études PACCOCATH (52 patients) puis celle d’Habara et al. en 2013 (137 patients) ont permis de démontrer une réduction significative du late loss, de la resténose et aussi du TLR.
Les études PEPCAD2 et ISAR DESIRE ont conforté le concept en comparant le ballon actif au TAXUS™ dans la resténose intrastent nu avec des résultats comparables, tant sur le plan clinique qu’angiographique.
Le ballon actif a également été évalué dans la resténose intrastent actif (principalement de première génération : TAXUS™ et CYPHER™).
La tendance générale de toutes les études est à la supériorité du ballon actif versus ballon seul (Habara 2011, PEPCAD DES et ISAR DESIRE 3) et son équivalence d’efficacité versus stent TAXUS™ (PEPCAD2, ISAR DESIRE 3 et PEPCAD China).
L’obtention récente de son remboursement dans le traitement de la première resténose clinique intrastent actif ou nu vient couronner ce programme scientifique très riche ainsi que son efficacité.
Il devrait permettre sa plus grande utilisation principalement limitée par des problèmes de coûts.
Les stents actifs
Le recours à un stent actif s’est très vite imposé comme une alternative très séduisante au traitement de la resténose intrastent, même si elle a été ébranlée un temps par la polémique plus générale sur les stents actifs et par le succès du ballon actif.
Très tôt, les études ISAR DESIRE 1, 2 et 3 ont montré la supériorité du CYPHER™ et du TAXUS™ dans le traitement de la resténose intrastent nu et actif par rapport au ballon seul et l’équivalence de ces deux prothèses dans cette indication.
Le bénéfice des stents actifs de 2e et 3e générations a également été démontré principalement dans des analyses de sous-groupes.
Nous ne disposons pas d’étude de grande taille ou suffisamment spécifique précisant cependant quel type d’endoprothèse doit être utilisée en fonction du type de stent actif ayant resténosé ou validant la supériorité éventuelle d’un stent actif de nouvelle génération sur ses concurrents.
Une étude permet cependant d’orienter notre choix vers une molécule différente de celle utilisée dans le stent ayant resténosé.
L’étude RIBS III a comparé ces deux stratégies chez 363 patients présentant une resténose intrastent actif. La première stratégie consistait à implanter systématiquement un stent délivrant un autre principe actif. La seconde avait recours principalement au même stent actif que celui précédemment utilisé ou au ballon.
La première stratégie a permis de diminuer significativement la resténose angiographique (22 % vs 40 % ; p = 0,008) et les TLR (6,3 % vs 13,5 % ; p = 0,003).
Quel traitement privilégier ?
L’étude RIBS IV a comparé le stent à l’évérolimus au ballon actif au paclitaxel chez 309 patients présentant une resténose intrastent actif de première génération (figure 5).
Figure 5. Schéma de l’étude RIBS IV.
Lors du suivi angiographique à 9 mois et clinique à 1 an, les résultats ont été très en faveur du stent à l’évérolimus (figure 6).
Figure 6. Résultats de l’étude RIBS IV.
La resténose angiographique a été respectivement de 11 % et 19 % (p = 0,06) et le TVR de 8 % et 16 % (p = 0,035). La métaanalyse « en réseau » de Siontis regroupant 26 études et près de 5 923 patients avec un suivi clinique jusqu’à 60 mois et angiographique (chez 84 % des patients) permet de répondre partiellement à la question du traitement à privilégier dans la resténose intrastent.
Dans cette métaanalyse, le critère d’analyse principal était la survenue d’une resténose angiographique entre 6 et 12 mois.
Par ordre d’efficacité décroissant sur le critère angiographique, on retrouve le stent à l’évérolimus, le ballon actif, le stent au sirolimus, le stent au paclitaxel, la brachythérapie, le stent nu, le ballon et enfin versus le Rotablator™ (tableau 2).
Selon ce travail, le traitement par ballon actif se placerait en deuxième position en termes d’efficacité, mais sans différence significative avec le stent au paclitaxel ou au sirolimus. Cependant, il manque dans cette étude les stents de dernière génération et très peu des resténoses traitées concernaient des stents à l’évérolimus, au zotarolimus ou au biolimus.
Les estimations sont exprimées en différences de pourcentage de sténose, avec IC à 95 % entre parenthèses.
Les différences négatives montrent que l’intervention listée dans la colonne de gauche est plus bénéfi que que celle de la rangée supérieure.
Les interventions sont ordonnées selon le classement d’efficacité.
Les estimations sont exprimées en différences de pourcentage de sténose, avec IC à 95 % entre parenthèses.
Les différences négatives montrent que l’intervention listée dans la colonne de gauche est plus bénéfi que que celle de la rangée supérieure.
Les interventions sont ordonnées selon le classement d’effi cacité.
Un traitement adapté à chaque situation
La prise en charge sera donc très souvent du sur mesure en obéissant à un certain nombre de règles :
• Analyse précise, si possible de l’ancien film, de l’aspect du stent sur une image de soustraction de type Stentwizz ou Stent-Boost.
• Ne pas hésiter à réaliser une image OCT pour déceler un déploiement incomplet, une mal-apposition ou une sous-expansion du stent resténosé.
• Prédilatation :
– utilisation d’un ballon non compliant 1.1 court pour éviter les dommages adjacents au stent ;
– au moindre effet savonnette, utiliser un cutting balloon ;
– bien s’assurer que le déploiement incomplet, la mal-apposition ou la sous-expansion ont été traités. Discuter au cas par cas le recours à un Rotablator™ en cas de stent mal déployé.
• En cas de resténose dans un stent actif :
– privilégier un ballon actif en cas de lésion focale ou sur une artère de petit calibre ;
– privilégier un stent avec une autre molécule (en priorité l’évérolimus le plus évalué), notamment en cas de resténose marginale (Ib), diffuse (II) ou proliférative (III) en s’assurant d’une couverture complète du stent et de l’utilisation finale d’un ratio ballon/artère à 1,1/1 et de haute pression (> 14 B) ;
– ne jamais implanter un deuxième stent en cas de déploiement incomplet ou de mal-apposition persistante.
Enfin, le meilleur traitement de la resténose intrastent est probablement préventif et réside dans la qualité de réalisation de la première angioplastie :
• Bien préparer la lésion notamment si la lésion est complexe (ballon adapté à la taille et NC si lésion calcifiée), en se limitant aux indications du direct stenting.
• Bien dimensionner le stent en diamètre et en longueur après l’utilisation systématique de Risordan IC en se persuadant que mieux vaut un stent légèrement sur-dimensionné que sous-dimensionné.
• Utiliser un stent actif plus long que le ballon de prédilatation, ayant un épaulement le plus court possible avec son propre ballon porteur et couvrant la totalité de la plaque.
• Avoir un recours le plus systématique possible à une imagerie de soustraction (StentBoost ou Stentwizz), et compléter la procédure par une postdilatation si cela semble nécessaire avec un ballon plus court que le stent.
Conclusion
Même si la resténose est devenue une complication très rare à l’ère d’une utilisation presque systématique des stents actifs, sa survenue parfois sur un mode instable et souvent retardé en fait toute sa gravité.
Si les possibilités de traitement sont multiples, ce dernier doit probablement être individualisé avec toujours l’obsession de ne pas méconnaître un sous-dimensionnement et une mal-apposition initiale.
"Publié dans Cath'Lab"
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :