Publié le 01 fév 2005Lecture 7 min
Nouvelle donne dans la prise en charge du postinfarctus avec insuffisance cardiaque
J. CHAPSAL, Paris
À l’occasion des Journées françaises de l’insuffisance cardiaque à La Baule en septembre dernier, ce symposium, organisé par les laboratoires Pfizer et coprésidé par J.-C. Daubert et M. Komajda, a fait le point sur la prise en charge de l’insuffisance cardiaque du postinfarctus et sur le rôle de l’éplérénone.
Une maladie grave dont la fréquence augmente
A. Cohen-Solal a rappelé la fréquence croissante de l’insuffisance cardiaque (IC) en raison du vieillissement de la population, et le nombre d’hospitalisations pour insuffisance cardiaque globale augmente, alors que celui des hospitalisations pour infarctus du myocarde diminue.
Dans un registre de 600 500 patients atteints d’infarctus colligés, entre 1994 et 2000, 29 % d’entre eux ont développé une insuffisance cardiaque, la mortalité hospitalière étant alors de 24 %, alors qu’elle n’est que de 6,2 % en l’absence d’IC.
De plus, les patients qui développent une insuffisance cardiaque au cours de leur hospitalisation ont une mortalité supérieure à celle des patients qui avaient déjà une insuffisance cardiaque à leur admission (31,5 vs 20,9 %).
Selon les données de Framingham (1999), l’incidence de l’insuffisance cardiaque chez les survivants d’infarctus est de 2 % par an.
CARE
Dans cette étude, 7 159 patients atteints d’infarctus, avec une fraction d’éjection > 0,25 et ayant survécu au moins 3 mois à leur infarctus, ont été suivis pendant 5 ans :
- 6,3 % de ces patients ont été hospitalisés pour insuffisance cardiaque ;
- dans 3 cas sur 4, cette insuffisance cardiaque n’était pas en rapport avec un nouvel infarctus ;
- on retrouve une incidence cumulative d’insuffisance cardiaque de 2,2 % par an.
Ces données confirment ce qui nous paraissait évident : les patients qui développeront une insuffisance cardiaque ont un risque vital plus élevé que ceux qui n’ont pas d’insuffisance cardiaque.
Dans CARE, le risque est multiplié par 10 et dans SAVE il est multiplié par 6 au terme d’un suivi de 3,5 ans. Le risque de survenue d’insuffisance cardiaque n’est pas homogène.
Ce risque dépend :
- de l’âge : 13 % des sujets après 70 ans développeront une IC vs moins de 2 % chez ceux âgés de moins de 50 ans ;
- de la fraction d’éjection.
Le remodelage, l’extension de l’infarctus et la fréquence de la mort subite observée dans l’insuffisance cardiaque du post-infarctus expliquent la gravité de cette pathologie.
En bref
- Si la fréquence de l’infarctus diminue, celle de l’insuffisance cardiaque ne diminue pas.
- Il faut insister sur l’importance d’un traitement préventif précoce du remodelage.
- La prise en charge spécifique de la mort subite reste à préciser.
Le remodelage ventriculaire après IDM
L’importance de l’activation neuro-hormonale
J.-J. Mercadier a rappelé que trois phases étaient observées dans l’IC du postinfarctus :
- une insuffisance cardiaque aiguë avec activation du système neuro-hormonal,
- une phase d’hypertrophie compensatrice,
- une insuffisance cardiaque tardive.
Des facteurs mécaniques s’opposent aux facteurs neuro-hormonaux systémiques (libération d’angiotensine II qui va stimuler les AT1 et AT2 récepteurs et libération de noradrénaline). L’angiotensine II et l’aldostérone vont, par ailleurs, stimuler les processus d’oxydation.
Existe-t-il un rôle plus spécifique de l’aldostérone ?
Expérimentalement, il existe une corrélation linéaire entre le remodelage et le taux d’extraction de l’aldostérone. L’angiotensine II et l’aldostérone ont la même action sur la cascade du remodelage, mais celle-ci est décalée dans le temps.
L’inhibition de l’aldostérone par l’éplérénone a un effet favorable additif dans le postinfarctus du myocarde lorsqu’elle est ajoutée à un IEC. Devant l’insuffisance cardiaque de l’infarctus, il faut :
- passer le cap hémodynamique,
- limiter la nécrose,
- laisser la zone infarcie cicatriser,
- favoriser l’hypertrophie bénéfique,
- prévenir l’hypertrophie délétère.
Un traitement précoce
Il existe un rationnel biologique et moléculaire pour utiliser des antagonistes des récepteurs des minéralocorticoïdes en plus des bloqueurs des AT1 récepteurs, et ce de façon précoce.
Une question mérite d’être posée : faut-il utiliser sans attendre ces antagonistes quand il y a une insuffisance cardiaque ?
Stratégie thérapeutique dans le postinfarctus
R. Isnard a rappelé que la mortalité dans le postinfarctus, compliqué d’insuffisance cardiaque ou de dysfonction ventriculaire gauche, est de 24 % à un an.
Comment traiter ?
L’ischémie et la sidération font appel à la revascularisation ;
les facteurs aggravants, comme l’insuffisance mitrale ischémique, font appel à la chirurgie.
Le rôle essentiel est dévolu aux médicaments « antiremodelage ».
Les IEC. Les études SAVE, AIRE, TRACE ont démontré leur effet bénéfique en diminuant la mortalité de façon très précoce, en diminuant les réadmissions pour IC et en diminuant les récidives d’infarctus.
L’administration précoce d’un IEC, chez 43 patients, permet d’éviter un événement.
Les sartans ? Les études OPTIMAAL (OPtimisation of Treatment In Myocardial infartion with AII Antagonist Losartan) et VALIANT (VALsartan In Acute myocardial iNfarction Trial) ont montré que les sartans font aussi bien que les IEC, mais ils doivent être administrés précocement.
Les bêtabloquants. Les bêtabloquants cardiosélectifs ont démontré une efficacité supérieure à celle des non cardiosélectifs. L’étude CAPRICORNE (CArvedilol Post-infaRct survIval COntRol in left ventricular dysfunctioN) a montré que l’ajout de bêtabloquants au traitement déjà optimal par les IEC permet une réduction absolue du risque de 2,30 %. Le traitement de 40 patients permet d’éviter un décès.
La prévention secondaire est essentielle : arrêt du tabac, emploi des statines, antiagrégants plaquettaires, voire chirurgie (résection d’anévrisme).
Le DEF. La mise en place d’un défibrillateur, un mois après un infarctus chez les patients ayant une fraction d’éjection < 0,30 entraîne une diminution de la mortalité de 31 % (MADIT II [Multicenter Automatic Defibrillator Implantation Trial]). À l’heure actuelle, il faut essayer de savoir à quels patients il faut proposer cette implantation.
En bref
- La « quadrithérapie » du post-IDM est bien codifiée, qu’il y ait ou non une dysfonction ventriculaire gauche et ou une insuffisance cardiaque : IEC, bêtabloquants, antiagrégants plaquettaires, statines.
- La place des traitements non médicamenteux doit être précisée.
- Le pronostic est sévère. Il faut faire plus !
Stratégies basées sur des preuves pour les patients avec un infactus récent (< 1 mois).
Peut-on mieux faire ?
EPHESUS
F. Zannad a rappelé les résultats de cette étude : l’adjonction d’un inhibiteur des récepteurs de l’aldostérone, l’éplérénone, améliore de façon significative le pronostic de l’IC du post-IDM.
De nombreux résultats, des analyses en sous-groupe et des études ancillaires ont permis de répondre à un certain nombre de questions pratiques.
L’éplérénone est une « cousine germaine » de la spironolactone ; elle s’en distingue par un délai et une durée d’action plus courts et une sélectivité beaucoup plus grande pour le récepteur minéralocorticoïde.
Dans l’étude ePhesus (EPlerenone in HEart failure Safety and efficacy and sUrvival Study), ce traitement par l’éplérénone a été initié en sus du traitement déjà considéré comme optimal : 70 % des patients recevaient des IEC, une majorité étaient sous statines et 50 % avaient été revascularisés.
L’éplérénone permet une réduction de la mortalité cardio-vasculaire de 17 %, une diminution de 21 % de la mort subite et une diminution de 15 % des hospitalisations pour insuffisance cardiaque.
Éplérénone : un effet cumulatif chez des patients à haut risque
- Dans l’étude CAPRICORNE, l’ajout de bêtabloquants aux IEC a permis d’observer une réduction relative du risque de 25 %.
- Dans EPHESUS, l’ajout d’éplérénone chez des patients déjà sous IEC et bêtabloquants a permis une réduction relative du risque de 15 %.
Il faut rappeler que les patients d’EPHESUS sont des patients à haut risque de mortalité. Une analyse « post hoc » a concerné les patients ayant eu une fraction d’éjection < 30 % (indication potentielle de MADIT II) : on observe une réduction de la mort subite en même temps qu’une diminution de la mortalité par progression de l’IC.
De ces éléments on peut conclure que, par rapport au DEF, l’éplérénone a une plus grande « rentabilité » : sur 100 DEF implantés, 8 seulement seraient utiles à un an.
Éplérénone : un rapport coût/efficacité bénéfique
L’éplérénone est efficace chez les patients diabétiques et dans plusieurs sous-groupes, notamment chez les patients hypertendus.
L’éplérénone diminue le nombre de patients hospitalisés pour IC et la durée des hospitalisations, ce qui représente une perspective intéressante dans le contexte économique actuel.
Éplérénone et kaliémie
Les facteurs suivants sont associés à un risque d’hyperkaliémie (cas > 6 mmM/l) :
- hyperkaliémie avant traitement,
- clairance de la créatinine diminuée,
- antécédents de diabète.
Il faut souligner que, malgré le risque d’hyperkaliémie observé dans EPHESUS, le bénéfice reste supérieur au risque et qu’à l’inverse, le risque d’hypokaliémie est nettement diminué par l’éplérénone, ce qui pourrait être un des facteurs explicatifs de la réduction observée des morts subites.
En pratique
Une action rapide. Dès les 12 premières heures suivant l’administration de l’éplérénone, on observe un effet favorable sur le remodelage, qu’il s’agisse de la fraction d’éjection ou des volumes télédiastolique et télésystolique.
À 30 jours, le bénéfice est démontré, mais celui-ci est encore plus grand à 60, puis à 90 jours.
Un traitement précoce. Pour observer l’effet positif de l’éplérénone, il faut débuter ce traitement entre 3 et 14 jours suivant la constatation de l’insuffisance cardiaque.
Un mécanisme de choix. On sait que la fibrose participe à l’insuffisance cardiaque et l’on distingue une fibrose cicatricielle, une fibrose réactive et une fibrose inflammatoire. Expérimentalement, l’éplérénone prévient l’apparition de la fibrose, ce qui est cohérent avec ce qui a déjà été observé dans l’insuffisance cardiaque chronique avec l’étude RALES (Randomized ALdactone Evaluation Study) où le collagène continue à s’accumuler. Dans EPHESUS, la synthèse du collagène inflammatoire est inhibée par l’éplérénone avec un effet antifibrotique consistant qui se maintient et s’amplifie au 9e mois.
Au total
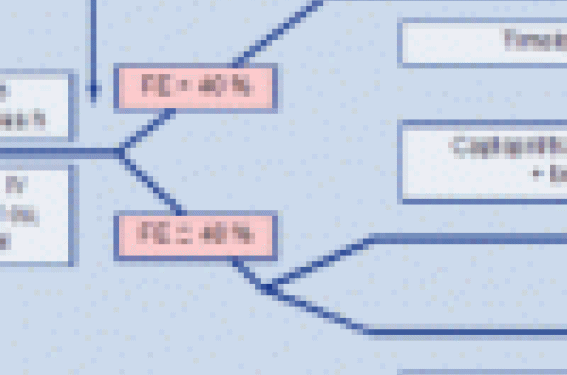
La stratégie de prise en charge de l’infarctus du myocarde récent (< 1 mois) est basée sur des preuves et peut être schématisée comme sur la figure.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité